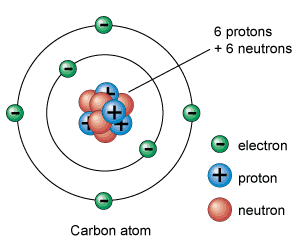
El Átomo es la unidad básica de toda la materia.
Está compuesto por partículas subatomicas:
Nombre Carga
Protón (p+) 1
Neutrón (n) 0
Electrón (e-) -1
-
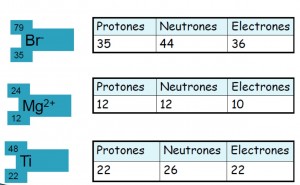
Número atómico (Z)
Indica el número de protones que posee el núcleo.
Z = p+
Cuando es un átomo neutro el número de electrones es igual al número de protones.
Z = p+ = e-
-
Número másico (A)
Es la suma entre los protones y neutrones
A = p+ + n
Como Z = p+ se cumple A = Z+ n
Despejando p+ + n tenemos
p+ = A -n Y n= A –p+
Para calcular el número de electrones nos basamos en dos cosas primero en el número de protones y segundo en la carga iónica que posee el elemento; si la carga iónica es + el número de electrones será igual a restarle al número de protones menos el número que indique la carga; si la carga iónica es - se procede hacer lo contrario al número de protones se le suma el número que indique la carga.
-
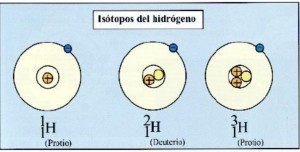
Isotopos o hílidos
Conjunto de átomos que pertenecen a un mismo elemento,que tienen igual número atómico y diferente masa atómica.Sus propiedades físicas son diferentes y sus propiedades químicas similares.
-
Isobaros
Conjunto de átomos que pertenecen a diferentes elementos que tienen el mismo número de masa atómica y diferente número atómico
-
Isótonos
Conjunto de átomos que pertenecen a diferentes elementos y que tienen el mismo número de neutrones.
-
Isoeléctronicos
Son átomos que tienen igual números de electrones.
-
Masas relativas
Nos permite determinar la masa real de un elemento de los diferentes isótopos que en este se forma



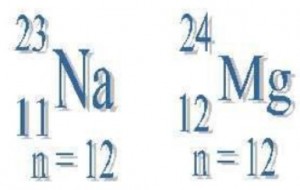




Comentarios recientes