elctroquimica
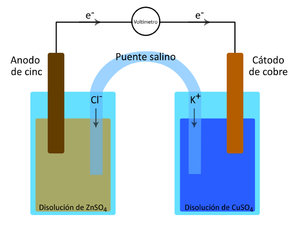
Desde el punto de vista Fisicoquímico los conductores más importantes son los del tipo electrolíticos, es decir los electrolitos; estos se distinguen de los conductores electrónicos, como los metales por el hecho de que el paso de una corriente eléctrica va acompañada por el transporte de materia. Cuando pasa una corriente eléctrica a través de un conductor electrolito, el transporte de materia se manifiesta en las discontinuidades del sistema. Por ej., si en una disolución acuosa diluida en un ácido se sumergen dos alambres, preferentemente de platino, unidos a los 2 polos de una batería voltaica que actúa como fuente de corriente, se desprenden en los alambres burbujas de hidrogeno y oxigeno respectivamente, si la disolución electrolítica contuviera una sal de cobre o plata se liberaría el metal correspondiente en lugar de hidrogeno. Los fenómenos asociados con la electrólisis fueron estudiados por Faraday y la nomenclatura que utilizó y que se emplea todavía fue ideada por Whewell. Las celdas electroquímicas se usan principalmente con dos fines: A) Convertir la energía química en eléctrica B) Convertir la energía eléctrica en química En las pilas secas comunes y en el acumulador de plomo tenemos convertidores de energía química en eléctrica, mientras que en la carga de la batería de almacenamiento y en la purificación electrolitica del cobre se utiliza la energía eléctrica para realizar una acción química. Una celda es un dispositivo simple de dos electrodos y un electrolito capaz de dar electricidad por la acción química dentro de la celda, o de producir una acción química por el paso de electricidad a su través. Una batería, por otra parte, es una combinación de dos o mas celdas dispuestas en serie o en paralelo. Así el acumulador de plomo es una batería constituidas por tres celdas conectadas en serie. El método mas común de determinar la diferencia de potencial entre dos puntos cualesquiera en un circuito eléctrico es el de conectar un voltímetro entre aquellos, leyendose directamente el voltaje con el instrumento 2. Ejemplo de cálculos a) Mediante la ec. De Nernst calcule el potencial de celda para cada par de soluciones Sea la sgte pila de Daniels: Zn/Zn+2 (a=1) // Cu+2 (a=1) /Cu Anodo Zn à Zn+2 + 2e- E0 = 0,763 v oxidación Catodo Cu+2 + 2e- à Cu E0 = 0,337 v reducción Rx: Zn (s) + Cu+2 (ac) +2e- ßà Zn+2 (ac) + Cu (s) + 2e- E0=1,1 v Calculo del potencial de celda Zn SO4 0,1M con CuSO4 0,1M Consideremos soluciones diluidas donde los coeficientes de a son iguales a los [ ] de las soluciones a = [M] aZn+2 = [MZn+2] aCu+2 = [MCu+2] } …..(1) Ec. de Nernst: E = E0 - RT Ln aZn+2 ……….(2) nF aCu+2 (2) en (1) E = E0 - RT Ln [MZn+2] ……….(2) nF [MCu+2] Luego reemplazando datos experimentales: E = 1,1 - (8,314)(298) Ln 0,1 (2e-)(96486) 0,1 E = 1,1 voltios Consideremos en el cálculo a los coeficientes de actividad (g) Sabemos a = g[M] g ZnSO4 = 0,15 g CuSO4= 0,4 Luego: E = 1,1 - (8,314) (298) Ln (0,15)(0,1) 2e- (96486) (0,4)(0,1) E = 1,11 v ZnSO4 0,1M con CuSO4 0,01M Aplicando Ec. de Nernst: E = 1,1 - (8,314)(298) Ln 0,1 (2e-)(96486) 0,01 E = 1,0704 voltios Luego: E = 1,1 - (8,314) (298) Ln (0,15)(0,1) 2e- (96486) (0,4)(0,01) E = 1,083 v ZnSO4 0,1M con CuSO4 0,001M E = 1,1 - (8,314)(298) Ln 0,1 (2e-)(96486) 0,001 E = 1,041 voltios Luego: E = 1,1 - (8,314) (298) Ln (0,15)(0,1) 2e- (96486) (0,4)(0,001) E = 1,053 v Porcentaje de errores: Para ZnSO4 0,1M, CuSO4 0,1M %E = Vt - Vexp x 100 Vexp %E = 1,1 - 1,042 x 100 %E = 5,27% 1,1 Para ZnSO4 0,1M, CuSO4 0,01M %E = 1,0704 - 1,005 x 100 %E = 6,11% 1,0704 Para ZnSO4 0,1M, CuSO4 0,001M %E = 1,0408 - 0,364 x 100 %E = 65% 1,0408 Utilizando la Ley de Faraday calcule la cantidad en gramos de hidrógeno liberado en el cátodo y compárelo con el obtenido experimentalemente. Sea: M(gr) = Peq x I x t / 96500 M = masa de sustancia Peq. = peso equiv. de sustancia I = amperios t = tiempo en seg. Para nuestra experiencia: t = 9'35'' ó 575 seg. M = (1gr)(0,3 A)(575 seg) / 96500 = 1,78 x 10-3 A Según nuestra experiencia se produjo 20 ml. de hidrogeno: Sabemos: 1 mol H2 ---------- 22,4 l X ---------- 2,0 x 10-2 l X = 8,928 x 10-4 moles de H2 Como: 1 mol H2 ---------- 2 gr 8,928 x 10-4 ------ W W = 1,79 x 10-3 gramos de H2 %Error = 1,78 -1,79 x 100 = 0,56 % 1,78 3. Discusión De Resultados En el estudio de la ecuación de Nernst al calcular las fem de las soluciones utilizando sus concentraciones (soluciones diluidas) los resultados fueron muy cercanos a los obtenidos en el laboratorio, obteniéndose pequeños márgenes de error para cada par de soluciones, pero se obtuvo un error muy grande en la tercera muestra, esto debido a una mala medición o uso del multimetro, o no poner fijamente los electrodos en su lugar, aun así el error de 65% fue demasiado grande a comparación de los otros dos. Cuando se conecto el multimetro en serie con cada celda galvánica y se cerro el circuito, el instrumento sufrió una deflexion que indica que la corriente pasa por el circuito, y este paso es una evidencia de que existe una diferencia de potencial entre los electrodos. Los resultados obtenidos al medir las 3 celdas con el multimetro fueron1,042v, 1,005v y 0,364v respectivamente donde se puede apreciar que el potencial decrece, mientras más diluida es la solución. Una seria objeción al uso del multimetro o del voltimetro para la medición exacta de los potenciales de celda (fem), es que este aparato consume alguna corriente, provocando así un cambio en la fem a causa de la formación de productos de reacción en los electrodos, por lo tanto, el potencial medido con este instrumento no será el total de la celda. Los coeficiente de actividad de las soluciones son mayores que las concentraciones utilizadas en esta practica, para esa razón la diferencia de potencial de los primeros es mayor que la de los segundos. Los resultados obtenidos en el estudio de la ley de Faraday son aceptables, habiéndose obtenido un 0,13% de error. 4. Conclusiones Y Recomendaciones La celda galvánica esta basada en la oxidación - reducción donde se produce un cambio en los #s de oxidación de las sustancias. Los electrones tienen que fluir por el circuito externo desde el electrodo negativo al positivo. En el electrodo negativo tiene lugar la oxidación y la reducción se verifica en el electrodo positivo. Al sumar las reacciones de oxid. y red. resulta la celda. Si las soluciones son diluidas, entonces se puede reemplazar en la Ec. Nernst las concentraciones por la actividad, por lo que se tiene que la diferencia entre actividad y molaridad es mínima. El uso del puente salino es importante pues concentra a las 2 soluciones, evita su mezcla además que elimina completamente el potencial de unión y que la fem medida es simplemente la suma de los 2 potenciales electródicos. La diferencia de potencial varía con la concentración, es decir mientras más diluida es la solución, el potencial decrecerá La masa desprendida en un electrodo de una solución es proporcional a la cantidad de electricidad que esta pasando Cuando se prepara las soluciones se debe tener cuidado de hacerlo en recipientes bien limpios, pues el potencial varía con la concentración. Se debe tener mucho cuidado cuando se esta efectuando el desprendimiento de hidrogeno, al igualar la presión en la pera y la bureta, así como de medir en tiempo exacto. Resumen En el informe siguiente determinaremos la diferencia de potencial existente entre una celda galvánica constituida de soluciones de CuSO4 y ZnSO4 (pila de Daniels) a diferentes concentraciones molares, y a una temperatura de 25°C. Esta medida de potencial la calcularemos experimentalmente usando un multímetro y electrodos de Zinc y Cobre (láminas delgadas) la cual compararemos con el resultado de la Ecuación de Nernst para celdas galvánicas. En esta primera parte de la experiencia preparamos soluciones de CuSO4 0,01M y 0,001M a partir de una solución 0,1M. De esta forma se obtuvo 3 pares de celdas de diferentes concentraciones (el ZnSO4 0,1M se utilizó para las 3 concentraciones de CuSO4). Al medir los potenciales con el multímetro arrojo los sgts resultados experimentales: 1,042v, 1,005v , 0,364v y al comparar con la ec. De Nernst, se obtuvo pequeños porcentajes de error: 5,27%, 6,11% . De donde se puede observar que el potencial de celda varía con la concentración es decir mientras mas diluida es la solución, el potencial decrece. Cuando en lugar de trabajar con molaridades, calculamos el fem utilizando los coeficientes de actividad de los iones observamos que estas nos daban un resultado mayor debido a que los coeficientes eran numéricamente mayores que las concentraciones. En la segunda parte de la practica comprobamos la ley de Faraday, para este fin preparamos los materiales y reactivos que indicaba la guía, es decir en una solución de NaOH introducimos dos electrodos de grafito, conectados directamente a la batería y uno de ellos además al equipo conteniendo agua (según gráfico). Experimentalmente introducimos al generador 20 ml de agua es decir 20 ml de hidrogeno (1,79x10-3gr) y al calcular los gramos H2 utilizando Faraday (se demoró 575 seg. En pasar 20 ml H2) nos dio un resultado de 1,7875x10-3gr , obteniendo un % de error del 0,56%.
 el agua libre de minerales no conduce electricidad, son los minerales disueltos en el agua los que los que conducen la electricidad, el hidrogeno y el oxigeno son dieléctricos
el agua libre de minerales no conduce electricidad, son los minerales disueltos en el agua los que los que conducen la electricidad, el hidrogeno y el oxigeno son dieléctricos
 Las estrellas cerca de los centros de las galaxias se mueven con mayor lentitud de lo que se creía, sugiriendo esto que hay más materia en el universo de lo que se pronosticaba. ¿Pero dónde se encuentra?
Las estrellas cerca de los centros de las galaxias se mueven con mayor lentitud de lo que se creía, sugiriendo esto que hay más materia en el universo de lo que se pronosticaba. ¿Pero dónde se encuentra?



