Números cuánticos
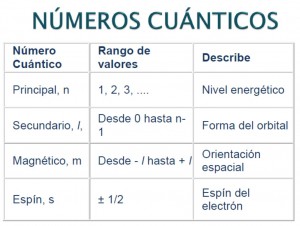
El modelo actual del átomo se basa en la mecánica cuántica ondulatoria, la cual está fundamentada en cuatro números cuánticos, mediante los cuales puede describirse un electrón en un átomo.
- Principal (n)
Su rango de valores es: 1,2,3,…,7
Define el nivel energético y el número máximo de electrones por nivel
- Azimutal (l)
Su rango de valores es: 0,1,2,… (n-1)
Indica el nivel de energía donde se encuentra el electrón y define la forma de los orbitales por medio de los subniveles
s= SPHERICAL 1 orbital 2 e max
p= PRINCIPAL 3 orbitales 6 e max
d= DIFUSSO 5 orbitales 10 e max
f= FUNDAMENTAL 7 orbitales 14 e max
- Magnético (ml)
Su rango de valores es : Desde – l hasta + l
Define orientación en el espacio de cada subnivel
- De giro o spin (ms)
Su rango de valores es: +1/2, -1/2
Define: el giro del electrón a favor o en contra de las manecillas del reloj
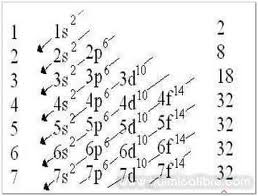
Configuración electrónica
Representación simbólica de la disposición de los electrones de un átomo en los diferentes subniveles (s, p ,d y f)
Utilizando el diagrama diagonal
Ejemplo:
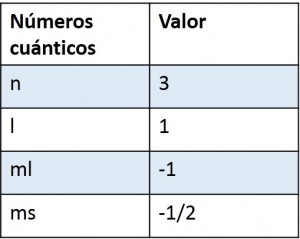
Determinar el conjunto de números cuánticos del ultimo electrón del átomo de azufre.
[important]
La configuración electrónica como su nombre lo dice es la configuración de los electrones en este caso el número de electrones del átomo de azufre será el mismo número que posee de protones 16.
[/important]
Utilizamos el diagrama diagonal hasta llegar a contar 16 electrones
S = 1s2, 2s2, 2p6, 3s2, 3p4
Los dos primeros números los obtenemos con la configuración (3p4)
- n Será igual al numero que esta antes del subnivel (s, p, d, f)
n =3
- El valor de l dependerá del subnivel si es: s = 0; p = 1; d = 2; f = 3
l= 1
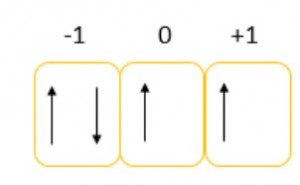
Para encontrar los otros dos números cuánticos se realiza el siguiente procedimiento
Los valores magenetico dependera segun el subnivel y pueden ser:
s 0
p -1 0 +1
d -2 -1 0 +1 +2
f -3 -2 -1 0 +1 +2 +3
El valor de espín podrá ser -1/2 o +1/2 y dependerá de en que posición caiga el electrón primero se llenan con flechas hacia arriba de izquierda a derecha, una flecha arriba por cada cuadro y después se empieza con flechas hacia abajo de izquierda a derecha; la ultima flecha determinara el valor si es hacia arriba sera +1/2 y si es hacia abajo -1/2
Según el diagrama
ml = -1
ms = -1/2
Entonces como podemos concluir que los números cuánticos para el ultimo electrón del átomo de azufre son:
En los siguientes enlaces podrán encontrar información mas detallada acerca de los números cuánticos y la configuración electrónica
1. http://web.educastur.princast.es/proyectos/jimena/pj_franciscga/ncuanticos.htm






2 comentarios
y para que sirve esto en la vida? exprese un ejemplo con diagrama de cuerpo libre pls
Autor
jajajajja sale lucho jajajja y todavia señor X 😀