Escuela Superior Politécnica del Litoral
CONCURSO SEMESTRAL DE EMPRENDIMIENTO CIENCIA Y TECNOLOGÍA
CSECT
Informe Final
Integrantes: Carlos Astudillo Riera
Luis Andrade
Fecha: 22/Agosto/2011
INSECTICIDA NATURAL A PARTIR DE EXTRACTOS VEGETALES
ECOKILLER
Introducción:
Los productos sintéticos destinados a controlar plagas y enfermedades en los vegetales han tenido un rol muy marcado en el incremento de la producción agrícola. Sin embargo el uso continuo e indiscriminado de estas sustancias, no sólo ha causado enfermedades y muertes por envenenamiento a corto y largo plazo, sino también ha afectado al medio ambiente, acumulándose por bioconcentración en los distintos eslabones de la cadena alimenticia, en el suelo y en el agua. Son responsables además de la resistencia a insecticidas por parte de los insectos, sin por ello restar importancia a la destrucción de parásitos, predadores naturales y polinizadores, entre los otros tantos integrantes del ecosistema, que han visto alterado su ciclo de vida a causa de estos productos. El hombre depende del consumo directo de las plantas tanto vegetales, cultivos, cereales como de la obtención de sus productos. Anualmente, una tercera parte de la producción de alimentos se ve destruida por pestes de cultivos y productos almacenados, por lo cual se hace imprescindible el estudio de nuevas vías de control de plagas. Las plantas, en conjunto, producen mas de 100.000 sustancias de bajo peso molecular conocidas también como metabolitos secundarios. Estos son, normalmente, no-esenciales para el proceso metabólico básico de la planta. Entre ellos se encuentran terpenos, lignanos, alcaloides, azúcares, esteroides, ácidos grasos, etc. Semejante diversidad química es consecuencia del proceso evolutivo que ha llevado a la selección de especies con mejores defensas contra el ataque microbiano, o la predación de insectos y animales. Hoy en día se sabe que estos metabolitos secundarios tienen un rol importante en el mecanismo defensivo de las plantas. Por lo tanto en los últimos años se está retornando al uso de las plantas como fuente de pesticidas mas seguros para el medio ambiente y la salud humana. Los pesticidas pueden ser clasificados de acuerdo con el tipo de organismo frente a los cuales son eficaces: funguicidas, herbicidas, insecticidas, moluscicidas, nematicidas, rodenticidas. Sin lugar a dudas los insecticidas naturales a partir de extractos vegetales constituyen una muy interesante alternativa de control de insectos además de que sólo se han evaluado muy pocas plantas en relación a la fuente natural que ofrece el planeta, por lo que las perspectivas futuras en cuanto a investigación, son aún mayores.
Objetivo:
- Encontrar una nueva alternativa natural para el control de insectos y plagas, reemplazando así los pesticidas sintéticos implementando así los insecticidas botánicos ofreciendo seguridad para el medio ambiente y una eficiente opción agronómica.
Fundamentación:
- Toxicidad: Los insecticidas naturales también representan riesgos y beneficios, los cuales es necesario considerar, así como sus formas de uso.
- Uno de los componentes principales °piretro° presenta riesgos para las personas en una inhalación o exposición prolongada por lo que se recomienda tomar las respectivas medidas preventivas como:
- Realizar las aspersiones en el momento en que ya no se va a ocupar el lugar en el que se efectuara el producto.
- Mantener fuera del alcanza de niños y personas de discapacidad intelectual.
- No representa mayor amenaza con respecto a su impacto con el medio ambiente.
- Apenas es tóxico para los mamíferos o pájaros, pero es altamente nocivo para ciertos peces, insectos e invertebrados acuáticos.
- Componentes Activos:
PIRETRINA
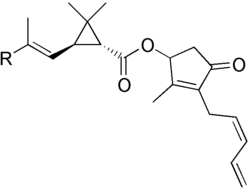
Figura 1. Estructura química de las piretrinas. * piretrina I: R = CH3 * piretrina II: R = CO2CH3
Las piretrinas (figura 1) son una mezcla de compuestos orgánicos que se encuentran de modo natural en las flores de plantas del género Chrysanthemum, como Chrysanthemum cinerariaefolium (denominado piretro o pelitre) o Chrysanthemum coronarium.Hasta un 20-25% del extracto seco de estas flores está formado por piretrinas, cuyos constituyentes se clasifican en dos grupos: las piretrinas I (CnH28O3) y las piretrinas II (CnH28O5), donde n puede ser 20, 21 ó 22. Con el avance de la química orgánica entre 1919 y 1966 se han desarrollado unas versiones sintéticas de las piretrinas denominadas piretroides.2
Aunque la actividad insecticida de este extracto ya era conocida en China desde el 1000 aC., su uso se extendió a partir del siglo XIX cuando se aplicó en la eliminación de piojos.Las piretrinas se usan para controlar una amplia variedad de insectos (mosquitos, orugas, escarabajos, etc.) en el ámbito doméstico o en invernaderos. También se emplean como principios activos en productos fitosanitarios para tratar los animales domésticos o el ganado. Estas sustancias no se pueden usar en el exterior porque se degradan con relativa facilidad por la acción de la luz4 y del calor.5 Para aumentar su efectividad como insecticidas los preparados comerciales de piretrinas se acompañan de sustancias sinérgicas como el butóxido de piperonilo y el sulfóxido de piperonilo.
Características físicas y químicas
Dentro de las piretrinas se conocen seis sustancias biológicamente activas con propiedades insecticidas. Estas moléculas se clasifican en los dos grupos antes señalados y sus propiedades se recogen en la tabla 1. Las moléculas del grupo piretrinas I son ésteres del ácido crisantémico y las del grupo piretrinas II son ésteres del ácido pirétrico.
| Tabla 1. Propiedades físicas y químicas de las piretrinas |
| Grupo |
Piretrinas I |
Piretrinas II |
| Compuesto químico |
piretrina I |
cinerina I |
jasmolina I |
piretrina II |
cinerina II |
jasmolina II |
| Estructura química |
|
|
|
|
|
|
| Fórmula química |
C21H28O3 |
C20H28O3 |
C21H30O3 |
C22H28O5 |
C21H28O5 |
C22H30O5 |
| Masa molecular |
328,4 |
316,4 |
330,4 |
372,4 |
360,4 |
374,4 |
| Punto de ebullición (°C) |
170 |
136-138 |
– |
200 |
182-184 |
– |
| Presión de vapor (mmHg) |
2,02 x 10-5 |
1,1 x 10-6 |
4,8 x 10-7 |
3,9 x10-7 |
4,6 x 10-7 |
1,9 x 10-7 |
| Solubilidad acuosa (mg/L) |
0,35 |
3,62 |
0,60 |
125,6 |
1038 |
214,8 |
| T medio volatilización (días) |
1,8 |
2,7 |
1,9 |
73,2 |
97,0 |
36,8 |
Actividad insecticida
La actividad insecticida de las piretrinas y piretroides se debe a su acción sobre la bomba de sodio de las neuronas. Mediante un proceso fisicoquímico estas moléculas inhiben el cierre del canal de sodio de la membrana celular, de manera que producen una transmisión continua del impulso nervioso. Las consecuencias de esta transmisión continua son los temblores, la parálisis muscular (llamado «efecto derribo» o «knock-down», característico de las piretrinas II) y, eventualmente, la muerte (específica de las piretrinas I). Esta actividad insecticida, que afecta especialmente a los insectos voladores, depende de la estructura química.Para potenciar su acción insecticida, y con efectos sinérgicos, se añade butóxido de piperonilo.
Efectos tóxicos y su tratamiento
La incorporación de las moléculas de piretrinas a un organismo animal (incluido el humano) puede realizarse por tres vías: dérmica, pulmonar (tras rociar la atmósfera con un producto que las contenga) y gástrica (por ingestión de comidas y bebidas contaminadas con estas sustancias). La absorción de piretrinas es más alta por las dos últimas vías. Una vez en el organismo, y según estudios realizados en modelos animales, parece que se eliminan con relativa facilidad ya que se dispone de enzimas hepáticos para su degradación.
No obstante, cuando se produce una exposición prolongada o excesiva a las piretrinas y sus análogos, se han señalado efectos indeseables por su acción sobre el sistema nervioso central y, en menor medida, sobre el sistema nervioso periférico y muscular. Algunos de estos efectos, que dependen de la vía de entrada, son hormigueo, picor, calor, dolor de cabeza, dificultad respiratoria, etc. Tales síntomas son más acusados en niños que en adultos y su severidad depende de la presencia de otras enfermedades en el sujeto afectado.
Por otro lado, aunque se ha señalado que altas dosis de piretrinas inducen el desarrollo de tumores hepáticos en ratas, no se tienen pruebas de que exista tal riesgo en humanos.
Para el tratamiento de la intoxicación por piretrinas se recomienda:
- uso de antihistamínicos para controlar las reacciones alérgicas.
- apoyo respiratorio para las reacciones de anafilaxis.
- aplicación de corticoesteroides tópicos para la dermatitis por contacto.
- enjuagado de los ojos en el caso de contaminación ocular.
Efectos medioambientales
Las piretrinas son inestables en el agua, hidrolizándose en compuestos carentes de toxicidad. También se degradan fácilmente por acción de la luz solar y del calor. Su persistencia en el suelo depende de diversos factores (viento, luz, temperatura y humedad ambientales, etc.), pero se ha estimado que poseen una semivida que varía entre las 1-2 horas hasta 12. En espacios interiores cerrados puede persistir hasta 2 meses.
Su impacto sobre las especies animales es variable: apenas es tóxico para los mamíferos o pájaros, pero es altamente nocivo para ciertos peces, insectos e invertebrados acuáticos.
Tanacetum cinerariifolium

El piretro o pelitre de Dalmacia (Tanacetum cinerariifolium sin. Chrysanthemum cinerariaefolium Vis.) es una planta de hoja perenne de la familia de las asteráceas, nativa de Dalmacia; es parecida a una margarita, con vistosas flores blancas, rosas o rojas.
La flor es buena para usarla como una flor duradera tras ser cortada para un ramo. La planta volverá a reflorar en el verano tardío si es podada.
Usos
La planta es importante económicamente como una fuente natural de insecticidas. Las flores son pulverizadas y los componentes activos, llamadas piretrinas, contenidos en las cubiertas de las semillas, son extraídos y vendidos en forma de oleoresina. Este componente es aplicado como una suspensión en agua, aceite o como polvo.
Las piretrinas atacan el sistema nervioso de todos los insectos, e impide a los mosquitoshembra picar. Cuando no están presentes en cantidades fatales para los insectos, siguen actuando como repelente para insectos. Son dañinos para los peces, pero son mucho menos peligrosos para los mamíferos y pájaros que muchos otros insecticidas sintéticos y no son persistentes, resultando ser biodegradables e incluso fotobiodegradables. Se les considera entre los insecticidas más seguros para usar cerca de la comida.
Kenia produjo el 90% (cerca de 6.000 t) del piretro del mundo en 1998, pero la producción en Tanzania está creciendo.
Los piretroides son insecticidas sintéticos basados en el piretro natural: un ejemplo es lapermetrina. Una formulación común de las piretrinas es en preparados que contienen el compuesto químico sintético butóxido de piperonilo: tiene el efecto de mejorar la toxicidad contra los insectos y acelerar los efectos comparados con los piretroides solos. Estas formulaciones se conocen como piretrinas sinergizadas.
Sinonimia
- Chrysanthemum cinerariifolium (Trevir.) Vis.
- Chrysanthemum rigidum Vis.
- Chrysanthemum turreanum Vis.
- Pyrethrum roseum M.Bieb.
- Chrysanthemum coccineum Willd.
- Tanacetum coccineum ( Willd. ) Grierson
Productos comerciales
- Raid es una marca de un insecticida popular hecho de piretrinas y butóxido de piperonilo.
- H24 es la marca de un insecticida bastante difundido, que utiliza piretroides como la aletrina entre otros.
Butóxido de piperonilo
El butóxido de piperonilo (BOP) es un sinérgico de pesticidas. Por sí mismo no tiene propiedades pesticidas. Sin embargo, cuando se añade a compuestos pesticidas, tales como con los insecticidas; piretrina, piretroides, y carbamatos, su potencia es incrementada considerablemente.
El butóxido de piperonilo es un potente inhibidor del Citocromo P450. Esta familia de enzimasson las principales que actúan en los mecanismos de detoxificación de muchos pesticidas. Inhibiendo los mecanismos de detoxificación permite que las concentraciones del insecticida dentro del organismo sean mayores ya que impide su metabolización haciendo que permanezca más tiempo dentro del cuerpo del insecto u organismo a eliminar.
El butóxido de piperonilo es moderadamente estable, y es un derivado semisintético del safrol.
Se debate si la sustancia es oncogénica, mutagénica, o teratogénica en humanos. Su toxicidad oral y dermal en mamíferos es baja.
Safrol
Safrol es un líquido graso incoloro o amarillo claro. Comúnmente se extrae de la raíz delsassafras en forma de aceite de sassafras, un aceite esencial. También puede ser sintetizado a partir de otros metilendioxicompuestos. Es el componente principal del aceite de alcanfor marrón (el alcanfor blanco no contiene safrol), y se encuentra en pequeñas cantidades en una gran variedad de plantas, donde cumple funciones de pesticida natural.
Carcinogénesis
El Safrol es un carcinógeno débil en ratas. De forma natural se encuentra en una gran variedad de especies como albahaca, canela,nuez moscada y pimienta. Se cree que el safrol contribuye en cierta medida (pequeña, aunque estimable) en la incidencia del cáncer humano. En Estados Unidos fue utilizado como aditivo en diversos alimentos hasta que fue prohibido por la FDA tras el descubrimiento de su potencial carcinógeno en ratas.
De acuerdo con un estudio, realizado en 1977, sobre los metabolitos del safrol en humanos y ratas, fueron hallados dos metabolitos carcinógenos en la orina de las ratas (1′-Hidroxisafrol y 3′-Hidroxisafrol) que no fueron hallados en la orina humana. Esto cuestiona tal carcinogénesis en humanos.
Uso en la síntesis de MDMA
El safrol es a menudo utilizado como el principal precursor para la síntesis clandestina deMDMA (Éxtasis). El procedimiento estándar consiste en la isomerización del safrol hasta isosafrol en presencia de una base fuerte, oxidación del isosafrol hasta 3,4-metilendioxi fenil-2-propanona, seguido de una aminación reductiva con metilamina hasta MDMA.
Es casi imposible conseguir grandes cantidades de safrol o aceite de sassafrás debido al duro control al cual se encuenran sometidos por la legislación vigente. El safrol, isosafrol y piperonal se encuentran en la Lista I de precursores químicos bajo regulación Nº 273/2004 en laComunidad Europea.
La corteza de la raiz del Sassafrás Americano contiene un bajo porcentaje de volátiles ricos en safrol. Intentar obtener safrol mediante la extracción del mismo de dicha fuente no es un buen método, en tanto que los rendimientos son bajos y el procedimiento es tedioso y caro.
PIRETRO
El piretro es en la actualidad el biopesticida de mayor uso y difusión.. Su extraordinario poder a un gran rango de insectos y su casi nulo impacto ambiental lo convierten en una de las armas más importantes que cuenta hoy en día la agricultura mundial y en especial la orgánica.
Historia
Los informes más antiguos sobre el piretro se remontan al primer siglo después de Cristo durante la Dinastía de Chou en China. No se conoce otra información más hasta la Edad Media donde comienza a verse en Persia probablemente llegada desde Tashkent por las Rutas de la Seda y finalmente en la Costa Dálmata.
A partir de ahí se esparce por varias zonas de Europa y finalmente en Sudamérica, Japón, Sudeste Asiático y África . Es en ese continente donde adquiere el mayor desarrollo, y fundamentalmente en Kenya.
Características principales
Gran cantidad de plantas contienen principios activos que actúan como insecticidas, y algunas de ellas se explotan comercialmente. De todas ellas el piretro es la que ha tenido la mayor difusión. Este deriva de la flor de una planta del género de los Chrysanthemun, Su nombre es Chrysanthemun cinerariefolium.
Los activos que lo constituyen se denominan piretrinas, que son ésteres orgánicos formados por la combinación de dos ácidos carbóxidos y tres alcoholes. La combinatoria de estos elementos son los que le brindan al extracto de piretro su acción insecticida y de volteo (knockdown).
Fórmula
Pyrethrin I C21 H28 O3
Pyrethrin II C22 H28 O5
Cinerin I C20 H28 O3
Cinerin II C21 H28 O5
Jasmolin I C21 H30 O3
Jasmolin II C22 H30 O5
Características generales
La piretrina natural posee una única combinación de propiedades que la convierte en el insecticida de mejores cualidades respecto de los insecticidas disponibles actualmente.
Estas cualidades podemos resumirlas en las siguientes:
Seguridad: Es el insecticida más seguro como consecuencia de su virtual atoxicidad para organismos de sangre caliente. Su toxicidad vía oral es de 2.350 mg/kg (en ratas).
Acción desalojante: El piretro es percibido por los insectos en forma instantánea y aún en pequeñas cantidades les crea una gran molestia, lo que le confiere una gran poder desalojante.
Volteo: Su rápida acción sobre el sistema nervioso de los insectos le da un gran poder de volteo.
Repelencia: Aun en pequeñas cantidades actúa como un gran repelente.
Contaminación y biodegradabilidad: Es un producto altamente biodegradable, por lo que es absolutamente no contaminante.
Rango de control: El piretro es un insecticida de amplio espectro que controla desde moquitos, pulgas, moscas, hormigas, e insectos en general.
Resistencia de los insectos: Si bien los componentes activos en el piretro son siempre los mismos, la proporcionalidad de estos va variando de cosecha en cosecha, de manera que nunca una partida de piretro es igual a otra, a diferencia de los insecticidas sintéticos que siempre son iguales. Estas ligeras diferencias evitan que los insectos logren crear resistencia a él.
Sassafras
Sasafrás es un género de plantas consistente en dos especies de árboles caducifolios de la familia de las Lauraceae, nativos del este de Norteamérica y este de Asia.
Descripción
El árbol de sasafrás crece hasta una altura de 15 a 35 m con muchas ramas esbeltas y una suave corteza de un color café amarillo. La ramificación es simpodial. La corteza del tronco principal es delgada, de color café rojizo, profundamente arrugada. La madera es ligera, suave, débil y quebradiza. Todas las partes de la planta son muy fragantes.
Las especies son excepcionales al tener 3 distintos patrones de hoja: oval no lobulada, bi-lobulada (con forma de guante) y tri-lobulada. Tienen bordes lisos y crecen de 7 a 20cm de largo por 5-10cm de ancho. Las hojas jóvenes y brotes son claramente mucilaginosos. Las pequeñas flores amarillas tienen 5 pétalos y florecen en primavera, son unisexuales, con flores hembra y macho en árboles separados. Los frutos son entre azul y negro, con forma de huevo, de un centímetro de largo, aparecen a lo largo de la copa y maduran en el verano.
Etimología
El nombre de sasafrás se le atribuye al destacado botánico español Nicolás Monardes (s. XVI). Se dice que es una corrupción de la palabra española saxifraga.También fue conocida con el nombre de «pauame» por los nativos americanos.
Especies
Usos
El aceite esencial destilado de la corteza, raíces y del fruto ha sido usado como fragancia en perfumes y jabones, en la comida (té de sasafras y saborizante de dulces) y para aromaterapia. También se ha usado como analgésico y como antiséptico en enfermedades dentales. La médula es utilizada para calmar la inflamación de ojos y el catarro leve.
La raíz o la corteza de la raíz también ha sido usada para hacer infusiones. Las diversas partes del árbol eran usadas para dar sabor a refrescos como la cerveza de raíz, conocida también como root beer o zarzaparrilla, cuyo sabor característico le viene de la corteza del sasafrás. Las hojas son usadas salsa y sopas, y cuando son secadas y molidas son conocidas como «polvo filé» un aderezo para la sopa de mariscos y otros platos de Louisiana.
Según se dice, el aroma del aceite de sasafras sirvió como base de repelentes de mosquitos y otros insectos, lo que la hizo una excelente planta de ornato. Un colorante amarillo se obtenía de la madera.
Componente activo
El safrol es el principal componente (70 a 80%) del aceite esencial, ha sido identificado por el United States Departament of Agriculture como un posible carcinógeno. El aceite de sasafrás ha sido la fuente preferida para la síntesis de (3,4-metilendioxianfetamina) también llamado MDA y sus derivados MDMA (Éxtasis) y MDE (Eva), de manera clandestina. Por ello su venta es vigilada por la DEA.
Procedimiento:

- Primero se procede con la investigación de los componentes peculiares de cada planta que poseen para alejar y repeler sus amenazas. Las plantas, en conjunto, producen mas de 100.000 sustancias de bajo peso molecular conocidas también como metabolitos secundarios. Estos son, normalmente, no-esenciales para el proceso metabólico básico de la planta. Entre ellos se encuentran terpenos, lignanos, alcaloides, azúcares, esteroides, ácidos grasos, etc. Semejante diversidad química es consecuencia del proceso evolutivo que ha llevado a la selección de especies con mejores defensas contra el ataque microbiano, o la predación de insectos y animales. Hoy en día se sabe que estos metabolitos secundarios tienen un rol importante en el mecanismo defensivo de las plantas.
- Luego de la selección de estas peculiares plantas, se procede a su recolección.
- Seleccionar y clasificar entre el material muerto del vivo, y dependiendo de la ubicación del componente activo de cada planta procedemos a tomar solo la parte que lo contenga.
- Una vez clasificado y seleccionado solo la parte del ingrediente activo, se pone a secar la planta.
- Luego de secar la planta o fracción, se procede a sacar su extracto o esencia por una destilación por arrastre de vapor como se muestra a continuación:
- Destilacion por arrastre de vapor: se lleva a cabo la vaporización selectiva del componente volátil de una mezcla formada por éste y otros «no volátiles». Lo anterior se logra por medio de la inyección de vapor de agua directamente en el interior de la mezcla, denominándose este «vapor de arrastre», pero en realidad su función no es la de «arrastrar» el componente volátil, sino condensarse en el matraz formando otra fase inmiscible que cederá su calor latente a la mezcla a destilar para lograr su evaporación.

| Laboratorio de Química Orgánica |
- La cantidad extraída se la pasa por un proceso de decantación en la que se lo deja reposar por un máximo de 1 día.
- Decantación: es un método físico de separación de mezclas heterogéneas, estas pueden ser formadas por un líquido y un sólido, o por dos líquidos. Es necesario dejarla reposar para que el sólido se sedimente, es decir, descienda y sea posible su extracción por acción de la gravedad. A este proceso se le llama desintegración básica de los compuestos o impurezas; las cuales son componentes que se encuentran dentro de una mezcla, en una cantidad mayoritaria.
- Mediante la decantación hemos eliminado el agua o alcohol (dependiendo el caso) de la esencia o extracto que hallamos obtenido y nos quedara el aceite con pequeños residuos del material con el que hallamos trabajado.

- Baño María: Para calentar al baño María hay que introducir un recipiente pequeño dentro de otro más grande lleno de agua y llevarlo al fuego. De este modo, lo que se calienta en primer lugar es el agua contenida en el recipiente de mayor tamaño y ésta es la que poco a poco va calentando el contenido del recipiente menor, de un modo suave y constante.

| Laboratorio de Química Orgánica / Carlos Astudillo |
- Finalmente tendremos una muy pequeña esencia de la planta con su ingrediente activo en alta concentración dentro. Procedemos a mezclar en pequeñas proporciones entre esencias de plantas diferentes hasta hallar un balance entre estas con la cual produzca un efecto insecticida o repulsivo para los insectos.
- Para terminar, diluimos la mezcla en agua para bajar su concentración y no resulte toxico para las personas.
Financiamiento:
Realmente, para la fabricación de este producto, se encuentran implícitos varios aspectos, entre ellos podríamos citar: los envases, la etiqueta, las plantas utilizadas para la extracción de las esencias, entre otros; y realizando un cálculo aproximado, podemos establecer el precio de EcoKiller, que lo evaluamos en $2,00.
El precio para tal producto es considerable, y creemos que está al alcance delas personas que deseen adquirirlo
Observaciones:
Cabe destacar que el tiempo que se emplea para este proceso, es considerable, pero seguro.
Mantener las precauciones propuestas para la elaboración del producto, ya que la demasiada o indiscriminada exposición a las esencias con el activo puede resultar toxico para quien lo elabora.
Conclusiones:
EcoKiller al ser un insecticida biodegradable a base de extractos naturales de plantas, no contamina el ambiente de su uso y no presenta mayor toxicidad en las personas; repeliendo, matando insectos y plagas varias parar proteger cultivos u hogar siendo un producto muy opcionado por el cuidado del planeta.
Bibliografía:
Enciclopedia Océano – Botánica
Paritarios.cl/especial_plaguicida.htm
Vivesur.com/insecticidas.htm
Jardineria.pro/18-04-2009/varios/ecologia/como-preparar-un-insecticida-natural
ANEXOS:





| Laboratorio de Química Orgánica |

| Laboratorio de Química Orgánica |