EQUILIBRIO QUIMICO---RESUMEN JULIO 31 DE 2009...TUVIMOS LECCION SOBRE VELOCIDAD Y CONSTANTE DE VELOCIDAD
Jul 31
2009
Modificaciones del equilibrio
El estado de equilibrio para un sistema químico está caracterizado por unas concentraciones o presiones parciales de reactivos y productos que permanecen inalteradas en el tiempo. Las concentraciones o presiones de equilibrio dependen de los valores iniciales y de la temperatura. Sin embargo, los equilibrios químicos son dinámicos y, por tanto, un cambio en las condiciones que los hacen posibles determina unas nuevas condiciones de equilibrio.
Principio de Le Chatelier
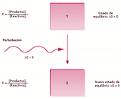
Cuando un sistema químico está en equilibrio (Q = K) (ver t13) y se le somete a una perturbación, el sistema evoluciona espontáneamente hacia un nuevo estado de equilibrio, que se caracteriza por unas concentraciones de reactivos y productos que cumplen la condición de equilibrio Q = K.
Existen tres variables que afectan al estado de equilibrio:
* Cambios en la concentración de las especies reaccionantes.
* Cambios en la presión y el volumen.
* Efecto de la temperatura.
La constante de equilibrio permite analizar cuantitativamente las alteraciones del estado de equilibrio; sin embargo, muchas veces no se dispone de información suficiente para llevar a cabo cálculos cuantitativos, por lo que es necesario un análisis cualitativo de la respuesta de un sistema ante una perturbación.
El principio de Le Chatelier es una herramienta cualitativa que indica la dirección del desplazamiento del equilibrio. Establece que «un cambio o perturbación en cualquiera de las variables que determinan el estado de equilibrio de un sistema químico, produce un desplazamiento del equilibrio en el sentido de contrarrestar o minimizar el efecto causado por la perturbación».
Cambios en las concentraciones de las especies reaccionantes
![]()
El cociente de reacción es:
![]()
Si se añade hidrógeno, Q Kc.
Cambios en la presión y el volumen
Para una reacción química cualquiera, un aumento de la presión (o disminución del volumen) provoca un desplazamiento del equilibrio en el sentido en el que se produce un menor número de moles de gas.
Una reducción de la presión (o un aumento del volumen) desplaza el equilibrio en el sentido en el que se produce un mayor número de moles de gas.
Los cambios de presión no afectan al equilibrio cuando Dn = 0, ya que, en este caso, el número de moles gaseosos a ambos lados de la ecuación es idéntico.
En las reacciones químicas en las que sólo participan sólidos y líquidos, los cambios de presión casi no afectan al estado de equilibrio, puesto que sólidos y líquidos son prácticamente incompresibles.
Tags: resumen clases





0