RESUMEN DE LA CLASE SOBRE COLOIDES
Jun 29
2009
ESTABILIZACION
Si bien las separación de los coloides sobre la base de la afinidad de sus micelas por el disolvente no es absoluta, por cuanto muchos soles, como los óxidos hidratados, se situan en un grupo intermedio entre los hidrófobos y los hidrófilos, es preferible estudiarlos desde este punto de vista y no, como se hacía antiguamente, en que se acostumbraba diferenciarlos en suspensoides y emulsoides, para lo cual se tomaba como base al estado en que se presenta el soluto. Si era sólido se estaba en presencia de un suspensoide y, si era líquido, de un emulsoide, siempre contando con que el disolvente era líquido.
El comportamiento de los coloides hidrófobos e hidrófilos es, en general, muy diferente y para poder ubicarlos en su justo término, es preciso tener en cuenta la viscosidad, tensión superficial, efecto Tyndall, presión oncótica, estabilidad y precipitación de cada uno de ellos.
La viscosidad y la tensión superficial de los coloides hidrófobos es similar a la del medio dispersante; asimismo, y debido a la gran división y pequeño diámetro de sus micelas, presentan intensamente el efecto Tyndall. Por el contrario, lo viscosidad de los hidrófilos, a causa de su avidez por el agua, es sensiblemente superior a la de la fase dispersante, mientras que su tensión superficial es inferior a la misma, y con el agregado de que estos coloides son batótonos, esto es, que descienden la tensión superficial del solvente y de otras soluciones, Los coloides hidrófilos no presentan el efecto Tyndall o lo hacen muy débilmente, lo que se explica por su hidrofilia que impide una distinción óptica entre las fases dispersa y dispersante, por lo que son de difícil observación mediante el ultramicroscopio.
Presión oncótica
La presión osmótica de las soluciones verdaderas depende de la concentración particular del soluto. Por ello, los coloides hidrófobos, de concentración particular muy débil, desarrollan muy escasa presión osmótica. En cambio, en los coloides hidrófilos concentrados, la presión osmótica adquiere valores mayores que los que se podría esperar si ella dependiera únicamente de la concentración del soluto, lo que se debe a que la hidrofilia de las micelas incrementa su avidez por el disolvente, originando una presión de retención muy superior a la osmótica y a la que se ha denominado oncótica. En estos casos, las micelas de los coloides hidrófilos retienen el disolvente en función de dos procesos: osmosis y óncosis que, si bien confluyen en un mismo fin difieren en su esencia. Así, mientras la primera representa la tendencia a diluirse que tiene la solución, en la óncosis el disolvente es fuertemente retenido por las micelas gracias a su hirirofilia.
En las soluciones muy diluidas, la presión osmótica de los coloides se confunde con la oncótica porque, en estos casos, el número de las micelas, o sea su concentración particular, es muy pequeño y la hidrofilia está en relación a él.
Estabilidad de los coloides hidrófobos o hidrófilos
Es muy grande y difiere según se trate de los coloides hidrófobos o hidrófilos. La estabilidad de los primeros depende de la carga eléctrica de sus micelas, que siendo de un misino signo para cada clase de coloides se mantienen en solución mediante un proceso de repulsión continua; la estabilidad de los hidrófilos depende del grado de hidratación de sus micelas.
Precipitación de los coloides hidrófobos
Los coloides hidrófobos son irreversibles, pues, una vez que sus micelas han sido precipitadas, no pueden ser dispersadas nuevamente. Por el contrario, los hidrófilos sen reversibles, por lo cual, sus micelas, una vez que han sido precipitadas, pueden volver a mezclarse con el medio de dispersión, para regenerar el sistema coloidal en solución.
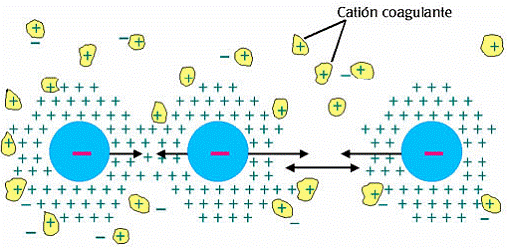
Para precipitar una partícula coloidal hidrófoba lo primero que hay que hacer es neutralizar su carga eléctrica, en cuyo caso basta con agregar a la solución un electrólito de signo contrario a la carga de la micela. Este fenómeno está contemplado por la regla de Hardy-Schulze que dice: «La precipitación de los coloides hidrófobos se efectúa, por iones de signo opuesto al de la partícula coloidal, y es tanto más intensa cuanto mayor es la valencia di dicho ión». Asimismo, cuanto mayor sea la velocidad con que se agrega el electrólito al coloide, mayor será el efecto precipitante.
Los coloides hidrófobos también pueden precipitarse mutuamente, siempre y cuando sus partículas sean de signo contrario y se mezclen en proporciones convenientes, porque si uno excede al otro, la mezcla resultante se estabiliza mediante la formación de una solución coloidal cuyo signo es el del coloide en exceso. Por ejemplo, en el cuadro se resumen las proporciones en que se han mezclado dos soles hidrófobos (el hidróxido de hierro coloidal, positivo, y el sulfuro de arsénico; negativo); como se ve, al predominar uno u otro se va precipitando un exceso, y el resto se carga de la misma electricidad que el coloide predominante.
Acción recíproca entre el As2S3 (negativo) y el Fe2O3 en solución (positivo)
Contenido en 10 ml de la mezcla Aspecto de la Solución Carga de las micelas
mg de Fe2O3 mg de As2S
0,61 20,3 Turbio Negativa
6,08 16,6 Precipitado Negativa
9,12 14,5 Precipitado Sin carga
15,2 10,4 Precipitado Positiva
24,3 4,14 Turbio Positiva
27,4 2,07 Invariable Positiva
Acción protectora
Para aumentar la estabilidad de los coloides hidrófobos, frente a los electrólitos de carga contraria, es común agregarles una pequeña cantidad de un coloide hidrófilo, cuya acción protectora se explica por uno de estos dos caminos o las partículas del primero son envueltas por las del segundo, aislándolas de las cargas del electrólito de signo contrario y, por consiguiente, evitando su neutralización, o bien el hidrófobo se adsorbe sobre el hidrófilo, reduciendo su libertad de acción.
La acción protectora de un coloide sobre otro ha sido denominada por Zsigmondy número de oro, entendiéndose por tal la cantidad mínima de coloide protector, expresada en miligramo, que es necesario agregar a 10 ml de una solución de oro coloidal rojo para impedir que su color vire hacia el azul violáceo cuando se le agrega 1 ml de ClNa al 10%.
Precipitación de los coloides hidrófilos.
La estabilidad de los coloides hidrófilos depende de su grado de hidratación. Por ello, para hacerlos precipitar se impone, como paso previo, la desaparición de la envoltura acuosa que se interpone entre la micela y la sustancia precipitante, lo que se consigue agregando a la solución una cierta cantidad de electrólito que, en lugar de actuar conforme a la regla de Hardy-Schulze, lo hace de acuerdo con su naturaleza en un orden determinado, conformando lo que se ha dado en llamar la serie de Hofmeister que, para los casos en que se quieren precipitar micelas de soluciones neutras o ligeramente alcalinas, adoptan la siguiente disposición:
Aniones:
SCN < I < NO < Cl < Acetato < Fosfato < SO4 < Tartrato < Citrato
Cationes:
Cs < Rb < K < Na < Li
De acuerdo con esta ordenación, los iones más activos son el citrato y el litio y, los menos actives, el sulfocianuro y el cesio. Cuando la reacción del medio se invierte, la serie de Hofmeister hace lo mismo.
Tags: Uncategorized







0