CLASE DE CINETICA QUIMICA ANTES DE LAS OBRAS DE TEATRO…
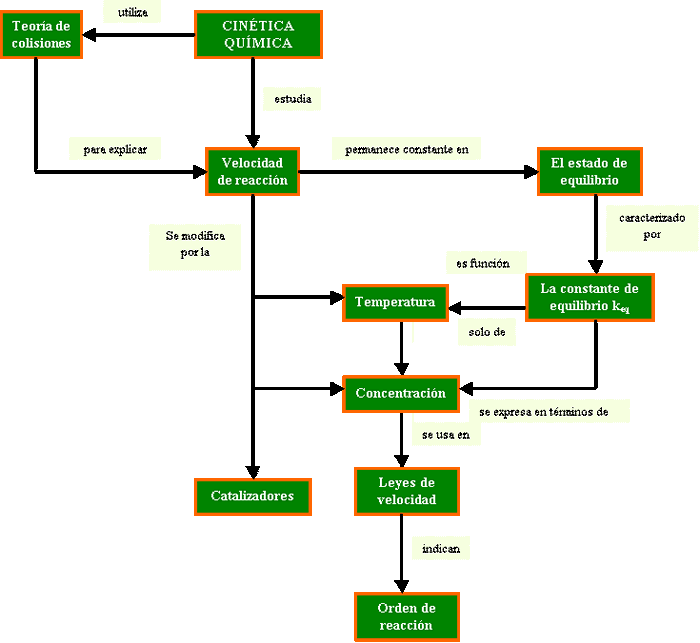
La cinética química estudia la velocidad de las reacciones químicas y los mecanismos mediante los que se efectúan. En 1864, Cato M. Guldberg y Peter Waage establecieron que la velocidad de reacción depende de la concentración de las especies reaccionantes y luego se conoció como la ley de acción de masas, que indica que la velocidad de reacción química es directamente proporcional a las masas activas de las especies reaccionantes. La masa activa depende del número de especies reaccionantes por unidad de volumen y se usa como sinónimo de concentración molar.
La velocidad de reacción química es la rapidez con que disminuye la concentración de un reactivo en la unidad de tiempo. La ley de acción de masas expresa que la velocidad de una reacción química es a cada instante proporcional a las concentraciones de los reactivos, estando cada una de las concentraciones elevada a una potencia igual al número de moléculas de cada especie que participa en la reacción química. El orden de reacción química es igual a la suma de los exponentes a los cuales están elevadas las concentraciones en la ecuación de velocidad de reacción.
De acuerdo con la ley de acción de masas, la velocidad de reacción de cualquier reacción química monomolecular del tipo:
A —> Productos, la velocidad de reacción en cualquier instante t es proporcional a la concentración de A y se representa mediante la ecuación: -dC/dt = k1CA . Donde –dC/dt representa la rapidez con que se transforman los reactivos en productos o la disminución de la concentración de los reactivos en el tiempo t, CA representa la concentración del reactivo A en el tiempo t y k1 se denomina velocidad de reacción específica o constante de velocidad de reacción de primer orden.
Si a es la concentración inicial y x la cantidad de A que se ha transformado por la reacción química en el tiempo t, entonces CA = (a – x) y sustituyendo en la ecuación de velocidad de reacción se tiene:
-d(a – x)/dt = dx/dt = k1(a – x), de donde reacomodando para integrar se tiene: òdx/(a – x) = k1òdt y tomando límites se obtiene: [-ln(a – x)]xo = [k1t]xo se obtiene ln(a/a – x) = k1t
Se define tiempo de vida media, t1/2, o periodo de vida media de una reacción química como el tiempo necesario para que se consuma o se transforme la mitad de la concentración inicial del reactivo, es decir, a – x = a/2. Sustituyendo en la ecuación anterior y despejando el tiempo de vida media se tiene:
t1/2 = 1/k1ln(a/a/2) = ln2/k1 = 0.693/k1
En la ecuación cinética anterior, se puede observar que en una reacción química de primer orden el tiempo de vida media es independiente de la concentración inicial de reactivo.
Dado que la radiactividad es un fenómeno nuclear, el proceso de desintegración no es alterado por un cambio en el estado o en las condiciones de la muestra. Un núclido radiactivo emite el mismo tipo de radiación a la misma velocidad con independencia del compuesto del que forme parte, de su temperatura, de la presión aplicada o de la presencia de campos electrostáticos, magnéticos o gravitacionales.
Los radionúclidos tienen diferentes estabilidades y se desintegran a distintas velocidades. Algunos se desintegran casi totalmente en fracciones de segundo, mientras que otros se desintegran en millones de años.
El decaimiento radiactivo de un núcleo inestable es un proceso que se representa mediante la ecuación de la velocidad de reacción química de primer orden -dC/dt = k1CA, pero usando una nomenclatura diferente: -dN/N = ldt donde –dN representa el número de núcleos que se desintegran en el intervalo de tiempo dt y l representa la constante de decaimiento del material radiactivo. La ecuación integrada es ln(N0/N) = lt o también ln(N0/N) = k1t, donde N0 representa el número de radionúclidos del inicio y N representa el número de desintegraciones por unidad de tiempo.
La radiactividad es un proceso aleatorio, en general, independiente de las influencias externas. Cuando el sistema está formado por un número grande de átomos el proceso de desintegración radiactiva es más predecible que cuando son átomos individuales. Se puede hacer mediante una propiedad característica de cada radioisótopo llamada vida media.
El tiempo de vida media o vida media (t1/2) de una muestra radiactiva es el tiempo que requiere para que la mitad de los núcleos de la muestra de un isótopo radiactivo se desintegre.
Como las desintegraciones radiactivas se comportan como las reacciones químicas de primer orden o reacción unimolecular como: A ——> Productos, la ecuación para determinar el tiempo de vida media de una muestra radiactiva es: t1/2 = ln2/ l = 0.693/l = t.
Para desintegración Cu64 ——> Zn64 + b- el tiempo de vida media es: t = 12.8 h.
La rapidez de desintegración de una muestra radiactiva se caracteriza por su tiempo de vida media.
El plutonio-240, producido en los reactores nucleares, tiene un tiempo de vida media de 6.58×103 años.
Se puede calcular la fracción restante del isótopo original después de un número dado de vidas medias por medio de la relación siguiente: 1/2n, donde “n” es el número de vidas medias transcurridas.
La cinética química estudia la velocidad de las reacciones químicas y los mecanismos mediante los que se efectúan. En 1864, Cato M. Guldberg y Peter Waage establecieron que la velocidad de reacción depende de la concentración de las especies reaccionantes y luego se conoció como la ley de acción de masas, que indica que la velocidad de reacción química es directamente proporcional a las masas activas de las especies reaccionantes. La masa activa depende del número de especies reaccionantes por unidad de volumen y se usa como sinónimo de concentración molar.
La velocidad de reacción química es la rapidez con que disminuye la concentración de un reactivo en la unidad de tiempo. La ley de acción de masas expresa que la velocidad de una reacción química es a cada instante proporcional a las concentraciones de los reactivos, estando cada una de las concentraciones elevada a una potencia igual al número de moléculas de cada especie que participa en la reacción química. El orden de reacción química es igual a la suma de los exponentes a los cuales están elevadas las concentraciones en la ecuación de velocidad de reacción.
De acuerdo con la ley de acción de masas, la velocidad de reacción de cualquier reacción química monomolecular del tipo:
A —> Productos, la velocidad de reacción en cualquier instante t es proporcional a la concentración de A y se representa mediante la ecuación: -dC/dt = k1CA . Donde –dC/dt representa la rapidez con que se transforman los reactivos en productos o la disminución de la concentración de los reactivos en el tiempo t, CA representa la concentración del reactivo A en el tiempo t y k1 se denomina velocidad de reacción específica o constante de velocidad de reacción de primer orden.
Si a es la concentración inicial y x la cantidad de A que se ha transformado por la reacción química en el tiempo t, entonces CA = (a – x) y sustituyendo en la ecuación de velocidad de reacción se tiene:
-d(a – x)/dt = dx/dt = k1(a – x), de donde reacomodando para integrar se tiene: òdx/(a – x) = k1òdt y tomando límites se obtiene: [-ln(a – x)]xo = [k1t]xo se obtiene ln(a/a – x) = k1t
Se define tiempo de vida media, t1/2, o periodo de vida media de una reacción química como el tiempo necesario para que se consuma o se transforme la mitad de la concentración inicial del reactivo, es decir, a – x = a/2. Sustituyendo en la ecuación anterior y despejando el tiempo de vida media se tiene:
t1/2 = 1/k1ln(a/a/2) = ln2/k1 = 0.693/k1
En la ecuación cinética anterior, se puede observar que en una reacción química de primer orden el tiempo de vida media es independiente de la concentración inicial de reactivo.
Dado que la radiactividad es un fenómeno nuclear, el proceso de desintegración no es alterado por un cambio en el estado o en las condiciones de la muestra. Un núclido radiactivo emite el mismo tipo de radiación a la misma velocidad con independencia del compuesto del que forme parte, de su temperatura, de la presión aplicada o de la presencia de campos electrostáticos, magnéticos o gravitacionales.
Los radionúclidos tienen diferentes estabilidades y se desintegran a distintas velocidades. Algunos se desintegran casi totalmente en fracciones de segundo, mientras que otros se desintegran en millones de años.
El decaimiento radiactivo de un núcleo inestable es un proceso que se representa mediante la ecuación de la velocidad de reacción química de primer orden -dC/dt = k1CA, pero usando una nomenclatura diferente: -dN/N = ldt donde –dN representa el número de núcleos que se desintegran en el intervalo de tiempo dt y l representa la constante de decaimiento del material radiactivo. La ecuación integrada es ln(N0/N) = lt o también ln(N0/N) = k1t, donde N0 representa el número de radionúclidos del inicio y N representa el número de desintegraciones por unidad de tiempo.
La radiactividad es un proceso aleatorio, en general, independiente de las influencias externas. Cuando el sistema está formado por un número grande de átomos el proceso de desintegración radiactiva es más predecible que cuando son átomos individuales. Se puede hacer mediante una propiedad característica de cada radioisótopo llamada vida media.
El tiempo de vida media o vida media (t1/2) de una muestra radiactiva es el tiempo que requiere para que la mitad de los núcleos de la muestra de un isótopo radiactivo se desintegre.
Como las desintegraciones radiactivas se comportan como las reacciones químicas de primer orden o reacción unimolecular como: A ——> Productos, la ecuación para determinar el tiempo de vida media de una muestra radiactiva es: t1/2 = ln2/ l = 0.693/l = t.
Para desintegración Cu64 ——> Zn64 + b- el tiempo de vida media es: t = 12.8 h.
La rapidez de desintegración de una muestra radiactiva se caracteriza por su tiempo de vida media.
El plutonio-240, producido en los reactores nucleares, tiene un tiempo de vida media de 6.58×103 años.
Se puede calcular la fracción restante del isótopo original después de un número dado de vidas medias por medio de la relación siguiente: 1/2n, donde “n” es el número de vidas medias transcurridas.










0