Que es la Teoría cuántica?
agosto 8th, 2011 publicado por josmvala
Teoría física basada en la utilización del concepto de unidad cuántica para describir las propiedades dinámicas de las partículas subatómicas y las interacciones entre la materia y la radiación. Las bases de la teoría fueron sentadas por el físico alemán Max Planck, que en 1900 postuló que la materia sólo puede emitir o absorber energía en pequeñas unidades discretas llamadas cuantos. Otra contribución fundamental al desarrollo de la teoría fue el principio de incertidumbre, formulado por el físico alemán Werner Heisenberg en 1927, y que afirma que no es posible especificar con exactitud simultáneamente la posición y el momento lineal de una partícula subatómica.
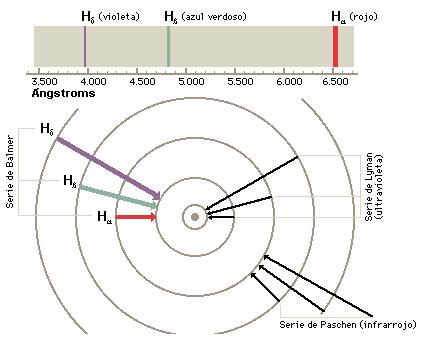
Cuando un electrón pasa de un nivel de energía a otro, emite un fotón con una energía determinada. Estos fotones dan lugar a líneas de emisión en un espectroscopio. Las líneas de la serie de Lyman corresponden a transiciones al nivel de energía más bajo o fundamental. La serie de Balmer implica transiciones al segundo nivel. Esta serie incluye transiciones situadas en el espectro visible y asociadas cada una con un color diferente.

Este fragmento pertenece al libro The Character of Physical Law (El carácter de la ley física, 1967), del físico teórico estadounidense Richard P. Feynman.
INTRODUCCIÓN HISTÓRICA
En los siglos XVIII y XIX, la mecánica newtoniana o clásica parecía proporcionar una descripción totalmente precisa de los movimientos de los cuerpos, como por ejemplo el movimiento planetario. Sin embargo, a finales del siglo XIX y principios del XX, ciertos resultados experimentales introdujeron dudas sobre si la teoría newtoniana era completa. Entre las nuevas observaciones figuraban las líneas que aparecen en los espectros luminosos emitidos por gases calentados o sometidos a descargas eléctricas. Según el modelo del átomo desarrollado a comienzos del siglo XX por el físico británico nacido en Nueva Zelanda Ernest Rutherford, en el que los electrones cargados negativamente giran en torno a un núcleo positivo, en órbitas dictadas por las leyes del movimiento de Newton, los científicos esperaban que los electrones emitieran luz en una amplia gama de frecuencias, y no en las estrechas bandas de frecuencia que forman las líneas de un espectro.
Otro enigma para los físicos era la coexistencia de dos teorías de la luz: la teoría corpuscular, que explica la luz como una corriente de partículas, y la teoría ondulatoria, que considera la luz como ondas electromagnéticas. Un tercer problema era la ausencia de una base molecular para la termodinámica. En su libro Principios elementales en mecánica estadística (1902), el físico estadounidense J. Willard Gibbs reconocía la imposibilidad de elaborar una teoría de acción molecular que englobara los fenómenos de la termodinámica, la radiación y la electricidad tal como se entendían entonces.
INTRODUCCIÓN DEL CUANTO DE PLANCK
A principios del siglo XX, los físicos aún no reconocían claramente que éstas y otras dificultades de la física estaban relacionadas entre sí. El primer avance que llevó a la solución de aquellas dificultades fue la introducción por parte de Planck del concepto de cuanto, como resultado de los estudios de la radiación del cuerpo negro realizados por los físicos en los últimos años del siglo XIX (el término ‘cuerpo negro’ se refiere a un cuerpo o superficie ideal que absorbe toda la energía radiante sin reflejar ninguna). Un cuerpo a temperatura alta —al rojo vivo— emite la mayor parte de su radiación en las zonas de baja frecuencia (rojo e infrarrojo); un cuerpo a temperatura más alta —al rojo blanco— emite proporcionalmente más radiación en frecuencias más altas (amarillo, verde o azul). Durante la década de 1890, los físicos llevaron a cabo estudios cuantitativos detallados de esos fenómenos y expresaron sus resultados en una serie de curvas o gráficas. La teoría clásica, o precuántica, predecía un conjunto de curvas radicalmente diferentes de las observadas. Lo que hizo Planck fue diseñar una fórmula matemática que describiera las curvas reales con exactitud; después dedujo una hipótesis física que pudiera explicar la fórmula. Su hipótesis fue que la energía sólo es radiada en cuantos cuya energía es hu, donde u es la frecuencia de la radiación y h es el ‘cuanto de acción’, ahora conocido como constante de Planck.
APORTACIONES DE EINSTEIN
Los siguientes avances importantes en la teoría cuántica se debieron a Albert Einstein, que empleó el concepto del cuanto introducido por Planck para explicar determinadas propiedades del efecto fotoeléctrico, un fenómeno experimental en el que una superficie metálica emite electrones cuando incide sobre ella una radiación.
Según la teoría clásica, la energía de los electrones emitidos —medida por la tensión eléctrica que generan— debería ser proporcional a la intensidad de la radiación. Sin embargo, se comprobó que esta energía era independiente de la intensidad —que sólo determinaba el número de electrones emitidos— y dependía exclusivamente de la frecuencia de la radiación. Cuanto mayor es la frecuencia de la radiación incidente, mayor es la energía de los electrones; por debajo de una determinada frecuencia crítica, no se emiten electrones. Einstein explicó estos fenómenos suponiendo que un único cuanto de energía radiante expulsa un único electrón del metal. La energía del cuanto es proporcional a la frecuencia, por lo que la energía del electrón depende de la frecuencia.
EL ÁTOMO DE BOHR
En 1911, Rutherford estableció la existencia del núcleo atómico. A partir de los datos experimentales de la dispersión de partículas alfa por núcleos de átomos de oro, supuso que cada átomo está formado por un núcleo denso y con carga positiva, rodeado por electrones cargados negativamente que giran en torno al núcleo como los planetas alrededor del Sol. La teoría electromagnética clásica desarrollada por el físico británico James Clerk Maxwell predecía inequívocamente que un electrón que girara en torno a un núcleo radiaría continuamente energía electromagnética hasta perder toda su energía, y acabaría cayendo en el núcleo. Por tanto, según la teoría clásica, el átomo descrito por Rutherford sería inestable. Esta dificultad llevó al físico danés Niels Bohr a postular, en 1913, que la teoría clásica no es válida en el interior del átomo y que los electrones se desplazan en órbitas fijas. Cada cambio de órbita de un electrón corresponde a la absorción o emisión de un cuanto de radiación.
La aplicación de la teoría de Bohr a átomos con más de un electrón resultó difícil. Las ecuaciones matemáticas para el siguiente átomo más sencillo, el de helio, fueron resueltas durante la segunda y tercera década del siglo XX, pero los resultados no concordaban exactamente con los datos experimentales. Para átomos más complejos sólo pueden obtenerse soluciones aproximadas de las ecuaciones, y se ajustan sólo parcialmente a las observaciones.
MECÁNICA ONDULATORIA
El físico francés Louis Victor de Broglie sugirió en 1924 que, puesto que las ondas electromagnéticas muestran algunas características corpusculares, las partículas también deberían presentar en algunos casos propiedades ondulatorias (véase Dualidad onda-corpúsculo). Esta predicción fue verificada experimentalmente pocos años después por los físicos estadounidenses Clinton Davisson y Lester Halbert Germer y el físico británico George Paget Thomson, quienes mostraron que un haz de electrones dispersado por un cristal da lugar a una figura de difracción característica de una onda. El concepto ondulatorio de las partículas llevó al físico austriaco Erwin Schrödinger a desarrollar una ‘ecuación de onda’ para describir las propiedades ondulatorias de una partícula y, más concretamente, el comportamiento ondulatorio del electrón en el átomo de hidrógeno.
Aunque esta ecuación diferencial era continua y proporcionaba soluciones para todos los puntos del espacio, las soluciones permitidas de la ecuación estaban restringidas por ciertas condiciones expresadas por ecuaciones matemáticas llamadas funciones propias o eigenfunciones (del alemán eigen, ‘propio’). Así, la ecuación de onda de Schrödinger sólo tenía determinadas soluciones discretas; estas soluciones eran expresiones matemáticas en las que los números cuánticos aparecían como parámetros (los números cuánticos son números enteros introducidos en la física de partículas para indicar las magnitudes de determinadas cantidades características de las partículas o sistemas). La ecuación de Schrödinger se resolvió para el átomo de hidrógeno y dio resultados que encajaban sustancialmente con la teoría cuántica anterior. Además, tenía solución para el átomo de helio, que la teoría anterior no había logrado explicar de forma adecuada, y también en este caso concordaba con los datos experimentales. Las soluciones de la ecuación de Schrödinger también indicaban que no podía haber dos electrones que tuvieran sus cuatro números cuánticos iguales, esto es, que estuvieran en el mismo estado energético. Esta regla, que ya había sido establecida empíricamente por Wolfgang Pauli en 1925, se conoce como principio de exclusión.

El físico británico George P. Thomson fue galardonado con el Premio Nobel de Física en 1937 por su descubrimiento de la difracción de los electrones por los cristales, probando así sus propiedades ondulatorias.
Posteriormente, Schrödinger demostró que la mecánica ondulatoria y la mecánica de matrices son versiones matemáticas diferentes de una misma teoría, hoy denominada mecánica cuántica. Incluso en el caso del átomo de hidrógeno, formado por sólo dos partículas, ambas interpretaciones matemáticas son muy complejas. El siguiente átomo más sencillo, el de helio, tiene tres partículas, e incluso en el sistema matemático relativamente sencillo de la dinámica clásica, el problema de los tres cuerpos (la descripción de las interacciones mutuas de tres cuerpos distintos) no se puede resolver por completo. Sin embargo, sí es posible calcular los niveles de energía. Al aplicar la matemática mecanocuántica a situaciones complejas, los físicos pueden emplear alguna de las muchas formulaciones matemáticas. La elección depende de la conveniencia de la formulación para obtener soluciones aproximadas apropiadas.
Aunque la mecánica cuántica describe el átomo exclusivamente a través de interpretaciones matemáticas de los fenómenos observados, puede decirse a grandes rasgos que en la actualidad se considera que el átomo está formado por un núcleo rodeado por una serie de ondas estacionarias; estas ondas tienen máximos en puntos determinados, y cada onda estacionaria representa una órbita. El cuadrado de la amplitud de la onda en cada punto en un momento dado es una medida de la probabilidad de que un electrón se encuentre allí. Ya no puede decirse que un electrón esté en un punto determinado en un momento dado.
EL PRINCIPIO DE INCERTIDUMBRE
La imposibilidad de determinar exactamente la posición de un electrón en un instante determinado fue analizada por Heisenberg, que en 1927 formuló el principio de incertidumbre. Este principio afirma que es imposible especificar con exactitud y al mismo tiempo la posición y el momento lineal de una partícula. En otras palabras, los físicos no pueden medir la posición de una partícula sin causar una perturbación en la velocidad de dicha partícula. Se dice que el conocimiento de la posición y de la velocidad son complementarios, es decir, que no pueden ser precisos al mismo tiempo. Este principio también es fundamental en la visión de la mecánica cuántica que suele aceptarse en la actualidad: los caracteres ondulatorio y corpuscular de la radiación electromagnética pueden interpretarse como dos propiedades complementarias de la radiación.
RESULTADOS DE LA MECÁNICA CUANTICA
La mecánica cuántica resolvió todas las grandes dificultades que preocupaban a los físicos en los primeros años del siglo XX. Amplió gradualmente el conocimiento de la estructura de la materia y proporcionó una base teórica para la comprensión de la estructura atómica y del fenómeno de las líneas espectrales: cada línea espectral corresponde a la emisión o absorción de un cuanto de energía o fotón, cuando un electrón experimenta una transición entre dos niveles de energía. La comprensión de los enlaces químicos se vio radicalmente alterada por la mecánica cuántica y pasó a basarse en las ecuaciones de onda de Schrödinger. Los nuevos campos de la física —como la física del estado sólido, la física de la materia condensada, la superconductividad, la física nuclear o la física de partículas elementales— se han apoyado firmemente en la mecánica cuántica.
AVANCES POSTERIORES
Desde 1925 no se han encontrado deficiencias fundamentales en la mecánica cuántica, aunque se ha debatido si la teoría debe o no considerarse completa. En la década de 1930, la aplicación de la mecánica cuántica y la relatividad especial a la teoría del electrón permitió al físico británico Paul Dirac formular una ecuación que implicaba la existencia del espín del electrón. También llevó a la predicción de la existencia del positrón, que fue comprobada experimentalmente por el físico estadounidense Carl David Anderson.
La aplicación de la mecánica cuántica al ámbito de la radiación electromagnética consiguió explicar numerosos fenómenos como la radiación de frenado (emitida por los electrones frenados por la materia) y la producción de pares (formación de un positrón y un electrón cuando la energía electromagnética interactúa con la materia). Sin embargo, también llevó a un grave problema, la denominada dificultad de divergencia: determinados parámetros, como las llamadas masa desnuda y carga desnuda de los electrones, parecen ser infinitos en las ecuaciones de Dirac (los términos ‘masa desnuda’ y ‘carga desnuda’ hacen referencia a electrones hipotéticos que no interactúan con ninguna materia ni radiación; en realidad, los electrones interactúan con su propio campo eléctrico). Esta dificultad fue parcialmente resuelta en 1947-1949 en el marco de un programa denominado renormalización, desarrollado por el físico japonés Shin’ichirō Tomonaga, los físicos estadounidenses Julian S. Schwinger y Richard Feynman y el físico estadounidense de origen británico Freeman Dyson. En este programa se toman la masa y carga desnudas del electrón como infinitas de modo que otras cantidades físicas infinitas se cancelen en las ecuaciones. La renormalización aumentó mucho la precisión en los cálculos de la estructura de los átomos a partir de los principios fundamentales.
PERSPECTIVAS DEL FUTURO
La mecánica cuántica está en la base de los intentos actuales de explicar la interacción nuclear fuerte y desarrollar una teoría unificada para todas las fuerzas fundamentales de la materia. No obstante, existen dudas sobre si la mecánica cuántica es o no completa. La dificultad de divergencia, por ejemplo, sólo se ha resuelto en parte. Igual que la mecánica newtoniana fue corregida por la mecánica cuántica y la relatividad, muchos científicos —Einstein era uno de ellos— están convencidos de que la mecánica cuántica también experimentará cambios profundos en el futuro. Por ejemplo, existen grandes contradicciones teóricas entre la mecánica cuántica y la teoría del caos, que empezó a desarrollarse rápidamente en la década de 1980. Los físicos teóricos como el británico Stephen Hawking siguen haciendo esfuerzos para desarrollar un sistema que englobe tanto la relatividad como la mecánica cuántica.
BIBLIOGRAFÍA
Categorías: General




