ASISTIMOS AL EVENTO QUE FUE ENRIQUECEDOR….

I EXPO & CONFERENCE BIOCOMBUSTIBLES Y AMBIENTE 2007, a desarrollarse 28, 29 y 30 de Mayo en el Hotel JW Marriott de la Ciudad de Quito-Ecuador.
El objetivo principal de dar a conocer este proyecto es de disminuir la importación de combustible, disminuir la contaminación ambiental, reactivar el sector del agro, crear fuentes de trabajo y a la vez la creación de nuevas industrias.
PROGRAMA
Hora 28 Mayo Conferencistas Invitados Tema
10h00 1er. PANEL Ministerio de Agricultura Brasil, Ministerio de Agricultura del Ecuador ANCUPA, Dr. Jorge Román ANCUPA UNCE, Ing. Astolfo Pincay Organización del sector productor de materia prima
Moderador: Ing. Temistocles Hernández, Fundación «SURCO»
——————————————————————————–
13h30 Almuerzo Ministerio de Energía de Brasil Políticas energéticas para el Desarrollo de Biocombustibles
Moderador: Ing. Luiz AugustoDafonseca
Comentarista: Roberto Urquizo, Subsecretario Ministerio Ambiente, Santiago Sanchez, Subsecretario Ministerio Energía y Minas
——————————————————————————–
16h00 Conferencia
Tecnológica Embajada India, posible invitado Agro-Energía materias primas alternativas, experiencia (piñón, jatrofa-kurka)
——————————————————————————–
17h00 Conferencia
Tecnológica PETROBRAS Logística del Alcohol en Brasil
——————————————————————————–
18h00 Conferencia
Tecnológica Valdez – Codana – Apale Experiencias
——————————————————————————–
19h00 Conferencia
Tecnológica «CIE» Corporación para Investigación energética, Ing. Alfredo Mena Propuesta de Legislación
——————————————————————————–
20h00 Cócte Inaugurall Invitado especiales: Presidente Republica, Econ. Rafael Correa, Ministro de Energía y Minas del Metropolitano de Quito
Feria Ecuador, Gral Paco Moncayo, Alcalde Distrito y demás autoridades del país.
Hora 29 Mayo Conferencistas Invitados Tema
10h00 2do. PANEL Ministerio Energía y Minas, Ing. Santiago Sánchez, Petroecuador, Ing. Julio Salazar, Ministerio de Industrias, FEDIMETAL Políticas y estrategias tecnológicas para la industrialización de BíoCombustibles
Moderador: Ing. Jorge Elizagaray, Presidente, Acero de los Andes
——————————————————————————–
13h30 Almuerzo PETROBRAS Experiencia en Bío-combustibles
Moderador: Sr. Hassan Becdach, Presidente HJ Becdach
Comentarista: Ing. Xavier Bustamante, Fundación Natura
——————————————————————————–
16h00 Conferencia
Tecnológica TERRASOL, Ing. Emanneul Narvaez
——————————————————————————–
16h30 Conferencia
Tecnológica CORPAIRE Dr. Jorge Oviedo
——————————————————————————–
17h00 Conferencia
Tecnológica Ministerio de Energía y Minas del Ecuador Ing. Mauro González. Proyecto piloto Guayaquil. Uso del BíoCombustible
——————————————————————————–
18h00 Conferencia
Tecnológica PETROBRAS Visión de cómo los Bío-combustibles pueden ser una alternativa confiable
——————————————————————————–
19h00 Conferencia
Tecnológica LA FABRIL CORPEI, Ing. Richar Hall, CAF, Dr. Luis Palao Experiencias
——————————————————————————–
20h00 3er. PANEL BID, CFN, Ing. Eduardo Valencia Financiamiento paral el desarrollo de proyectos de BíoCombustibles
Moderador: Dr. Kurt Freund
Hora 30 Mayo
Conferencistas Invitados Tema
10h00 4to. PANEL CEDENMA, F. SURCO Ing Temistocles Hernández
Universidad de San Francisco, ESPOL Guayaquil
Universidad Católica de Quito Ecuación Agro energía Vs. Agroalimentaria
Moderador: Dr. Alfredo Mena
——————————————————————————–
13h30 Almuerzo Alcalde de Quito, Gral. Paco Moncayo Visión sobre el uso de BíoCOmbustible en el Distrito
Moderador: Dr. Kurt Freund, Presidente del Directorio Metropolitano de Quito
——————————————————————————–
16h00 Conferencia
Tecnológica PETROBRAS H-Bio
——————————————————————————–
17h00 Conferencia
Tecnológica
Facultad de Petróleo y Energía Universidad Central del Ecuador, Ing. Patricio Izurieta G. El Bío-diesel el combustible del futuro.
——————————————————————————–
18h00 Conferencia
Tecnológica
——————————————————————————–
19h00 Conferencia
Tecnológica ANCUPA Cultivadores de palma, Ing. Vicente Landázuri BíoDiesel, una visión general
——————————————————————————–
20h00 Panel Ministerio de Energía y Minas , Ministerio de Ambiente, Ministerio de Agricultura del Ecuador Políticas nacionales para la producción y uso de BíoCombustibles en el Ecuador
Moderador: Dr. Jorge Roman, DANEC Gerente de proyectos
http://www.google.com.ec/url?q=http://www.tu.tv/videos/produccion-de-biodiesel-en-espol-dra-pa&ei=phlKSs-gLdWVtgfR-9iMCg&sa=X&oi=video_result&resnum=4&ct=thumbnail&usg=AFQjCNGOtAc0mb9_G875iUzcgWmyCnDOUg
…………………………………………
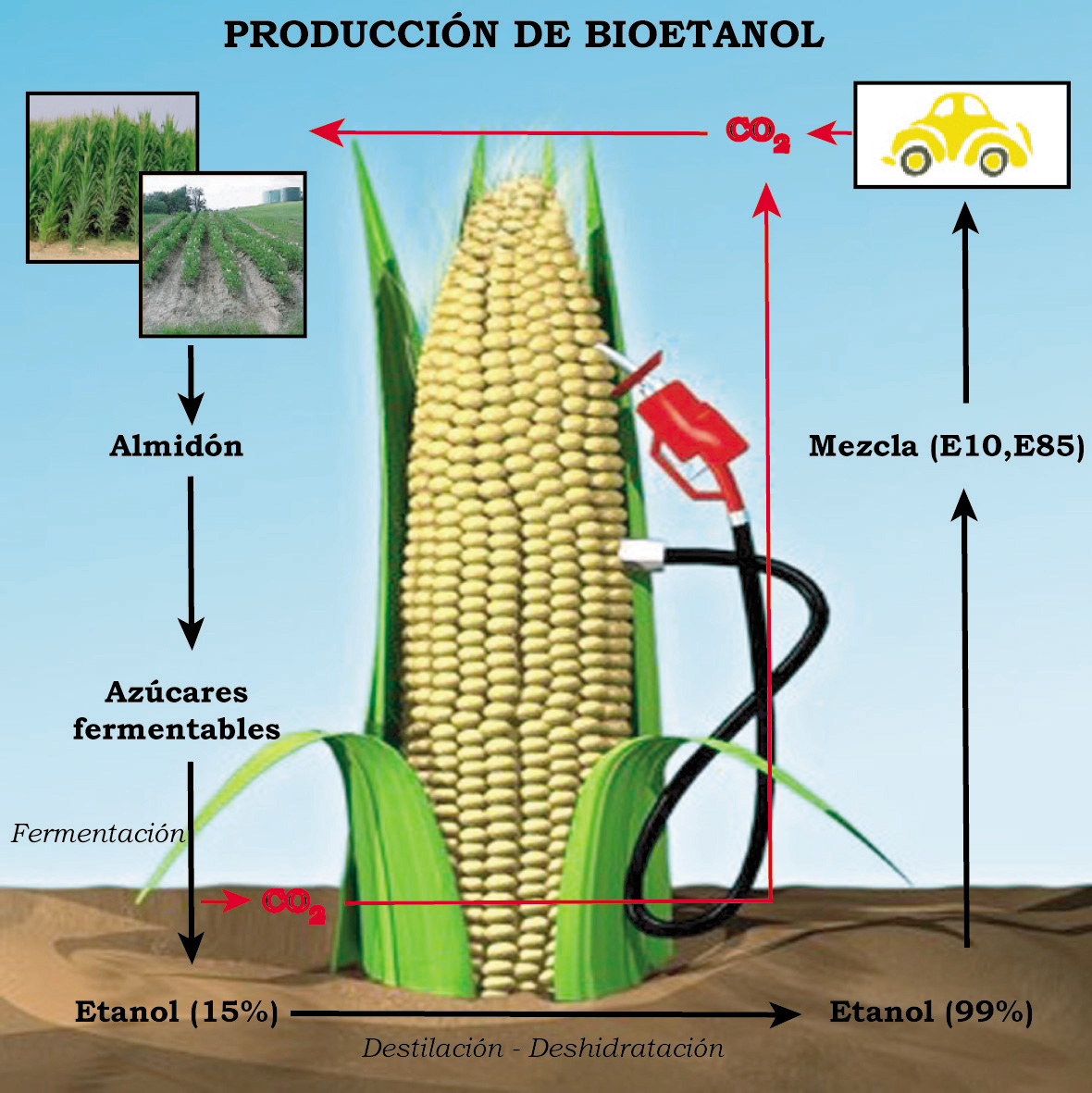
El biocombustible es el término con el cual se denomina a cualquier tipo de combustible que derive de la biomasa – organismos recientemente vivos o sus desechos metabólicos, tales como el estiércol de la vaca.
Los combustibles de origen biológico pueden sustituir parte del consumo en combustibles fósiles tradicionales, como el petróleo o el carbón.
Los biocombustibles más usados y desarrollados son el bioetanol y el biodiésel.
El bioetanol, también llamado etanol de biomasa, se obtiene a partir de maíz, sorgo, caña de azúcar, remolacha o de algunos cereales como trigo o cebada. En 2006, Estados Unidos fue el principal productor de bioetanol (36% de la producción mundial), Brasil representa el 33,3%, China el 7,5%, la India el 3,7%, Francia el 1,9% y Alemania el 1,5%. La producción total de 2006 alcanzó 55 mil millones de litros.[1]
El biodiésel, se fabrica a partir de aceites vegetales, que pueden ser ya usados o sin usar.[2] En este último caso se suele usar raps, canola, soja o jatrofa, los cuales son cultivados para este propósito. El principal productor de biodiésel en el mundo es Alemania, que concentra el 63% de la producción. Le sigue Francia con el 17%, Estados Unidos con el 10%, Italia con el 7% y Austria con el 3%.
Otras alternativas como son el Biopropanol y Biobutanol son menos populares, pero no pierde importancia la investigación en estas areas debido al alto precio de los combustibles fósiles y su eventual término.
Rendimiento
CULTIVO L/HA/AÑO TIPO
Palma 5500 biodiesel
Cocotero 4200 biodiesel
Higuerilla 2600 biodiesel
Aguacate 2460 biodiesel
Jatropha 1559 biodiesel
Colza 1100 biodiesel
Soja 840 biodiesel
Caña azu. 9000 bioetanol
Remolacha 5000 bioetanol
Yuca 4500 bioetanol
Sorgo dulce 4400 bioetanol
Maiz 3200 bioetanol
[3]
Regulación
En España existe un tipo impositivo especial para biocarburantes de cero euros por 1.000 L. El tipo especial se aplicará exclusivamente sobre el volumen de biocarburante aun cuando éste se utilice mezclado con otros productos.
Se consideran como biocarburantes los siguientes productos:
a) El alcohol etílico producido a partir de productos agrícolas o de origen vegetal (bioetanol) definido en el código NC 3207.20, ya se utilice como tal o previa modificación química.
b) El alcohol metílico (biometanol) definido en el código NC 2905.11.00 y obtenido a partir de productos de origen agrícola o vegetal, ya se utilice como tal o previa modificación química.
c) Los aceites vegetales definidos en los códigos NC 1507, 1508, 1510, 1511, 1512, 1513, 1514, 1515 y 1518, ya se utilicen como tales o previa modificación química.
Consecuencias sobre el medio ambiente
Este artículo o sección necesita fuentes o referencias que aparezcan en una publicación acreditada, como libros de texto u otras publicaciones especializadas en el tema.
Puedes dar aviso al autor principal del artículo pegando el siguiente código en su página de discusión: {{subst:Aviso referencias|Biocombustible}} ~~~~
El uso de biocombustibles tiene impactos ambientales negativos y positivos. Los impactos negativos hacen que, a pesar de ser una energía renovable, no sea considerado por muchos expertos como una energía no contaminante y, en consecuencia, tampoco una energía verde.
Una de las causas es que, pese a que en las primeras producciones de biocombustibles sólo se utilizaban los restos de otras actividades agrícolas, con su generalización y fomento en los países desarrollados, muchos países subdesarrollados, especialmente del sureste asiático, están destruyendo sus espacios naturales, incluyendo selvas y bosques, para crear plantaciones para biocombustibles. La consecuencia de esto es justo la contraria de lo que se desea conseguir con los biocombustibles: los bosques y selvas limpian más el aire de lo que lo hacen los cultivos que se ponen en su lugar.
Algunas fuentes afirman que el balance neto de emisiones de dióxido de carbono por el uso de biocombustibles es nulo debido a que la planta, mediante fotosíntesis, captura durante su crecimiento el CO2 que será emitido en la combustión del biocombustible. Sin embargo, muchas operaciones realizadas para la producción de biocombustibles, como el uso de maquinaria agrícola, la fertilización o el transporte de productos y materias primas, actualmente utilizan combustibles fósiles y, en consecuencia, el balance neto de emisiones de dióxido de carbono es positivo.
Otras de las causas del impacto ambiental son las debidas a la utilización de fertilizantes y agua necesarios para los cultivos; el transporte de la biomasa; el procesado del combustible y la distribución del biocombustible hasta el consumidor. Varios tipos de fertilizantes tienden a degradar los suelos al acidificarlos. El consumo de agua para el cultivo supone disminuir los volúmenes de las reservas y los caudales de los cauces de agua dulce.
Algunos procesos de producción de biocombustible son más eficientes que otros en cuanto al consumo de recursos y a la contaminación ambiental. Por ejemplo, el cultivo de la caña de azúcar requiere el uso de menos fertilizantes que el cultivo del maíz, por lo que el ciclo de vida del bioetanol de caña de azúcar supone una mayor reducción de emisiones de gases de efecto invernadero respecto al ciclo de vida de combustibles fósiles con más efectividad que el ciclo del bioetanol derivado del maíz. Sin embargo, aplicando las técnicas agrícolas y las estrategias de procesamiento apropiadas, los biocombustibles pueden ofrecer ahorros en las emisiones de al menos el 50% comparando con combustibles fósiles como el gasóleo o la gasolina.
El uso de biocombustibles de origen vegetal produce menos emisiones nocivas de azufre por unidad de energía que el uso de productos derivados del petróleo. Debido al uso de fertilizantes nitrogenados, en determinadas condiciones el uso de biocombustibles de origen vegetal puede producir más emisiones de óxidos de nitrógeno que el uso de productos derivados del petróleo.
Una solución real pero aún no disponible es la utilización de residuos agroindustriales ricos en hemicelulosas. De esta forma no se utilizarían areas de cultivos nuevas ni utilización de alimento para la producción de biocombustibles. un ejemplo de esto es la utilzación de coseta de remolacha, paja de trigo coronta de maíz ó cortezas de árboles. La hidrólisis de estos compuestos es más compleja que la utilización de almidón para la obtención de azúcares libres fermentables, por lo tanto, requiere de una mayor cantidad de energia inicial para procesar los compuestos antes de la fermentación, sin embargo, el costo de producción es casi nulo al considerar que se trata de residuos. La única tecnología eficiente y limpia es la utilización de enzimas hemicelulolíticas. Existen tres puntos claves que se deben solucionar o perfeccionar antes de aplicar esta tecnología. 1) Se deben encontrar enzimas más estables y eficientes. 2) Métodos menos destructivos de inmovilización de enzimas para su utilización industrial. 3) Microorganismos capaces de fermentar eficientemente monosacáridos derivados de las hemicelulosas (xilosa y arabinosa principalmente).
Consecuencias para el sector alimentario
Este artículo o sección necesita fuentes o referencias que aparezcan en una publicación acreditada, como libros de texto u otras publicaciones especializadas en el tema.
Puedes dar aviso al autor principal del artículo pegando el siguiente código en su página de discusión: {{subst:Aviso referencias|Biocombustible}} ~~~~
Artículo principal: Crisis alimentaria mundial (2007-2008)
Al comenzar a utilizarse suelo agrario para el cultivo directo de biocombustibles, en lugar de aprovechar exclusivamente los restos de otros cultivos (en este caso, hablamos de «biocombustibles de segunda generación»), se ha comenzado a producir un efecto de competencia entre la producción de comida y la de biocombustibles, resultando en el aumento del precio de la comida.
Un caso de este efecto se ha dado en Argentina, con la producción de carne de vaca. Las plantaciones para biocombustible dan beneficios cada seis meses, y los pastos en los que se crían las vacas lo dan a varios años, con lo que se comenzaron a usar estos pastos para crear biocombustibles. La conclusión fue un aumento de precio en la carne de vaca, duplicando o incluso llegando a triplicar su valor en Argentina.
Otro de estos casos se ha dado en México, con la producción de maíz. La compra de maíz para producir biocombustibles para Estados Unidos ha hecho que en el primer semestre de 2007, la tortilla de maíz -que es la comida básica en México- duplique o incluso llegue a triplicar su precio.
En Italia el precio de la pasta se ha incrementado sustancialmente dando lugar en septiembre de 2007 a una jornada de protesta consistente en un boicot a la compra de este producto típico de la comida italiana. También España registró en septiembre de 2007 una subida del precio del pan causado por el aumento en origen del precio de la harina.
Segunda generación
Las empresas de capital riesgo de Estados Unidos han decidido dar la espalda al etanol procedente del cultivo de maíz e invertir en productores que utilicen algas, residuos forestales y agrícolas u otro tipo de residuos.[4]
tOMADO DE WIKIPEDIA

Centro de convenciones Simon Bolivar
Tags: Uncategorized







2