EQUILIBRIO QUIMICO—RESUMEN JULIO 31 DE 2009…TUVIMOS LECCION SOBRE VELOCIDAD Y CONSTANTE DE VELOCIDAD
Jul 31
2009
Modificaciones del equilibrio
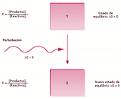
El estado de equilibrio para un sistema químico está caracterizado por unas concentraciones o presiones parciales de reactivos y productos que permanecen inalteradas en el tiempo. Las concentraciones o presiones de equilibrio dependen de los valores iniciales y de la temperatura. Sin embargo, los equilibrios químicos son dinámicos y, por tanto, un cambio en las condiciones que los hacen posibles determina unas nuevas condiciones de equilibrio.
Principio de Le Chatelier
Cuando un sistema químico está en equilibrio (Q = K) (ver t13) y se le somete a una perturbación, el sistema evoluciona espontáneamente hacia un nuevo estado de equilibrio, que se caracteriza por unas concentraciones de reactivos y productos que cumplen la condición de equilibrio Q = K.
Existen tres variables que afectan al estado de equilibrio:
* Cambios en la concentración de las especies reaccionantes.
* Cambios en la presión y el volumen.
* Efecto de la temperatura.
La constante de equilibrio permite analizar cuantitativamente las alteraciones del estado de equilibrio; sin embargo, muchas veces no se dispone de información suficiente para llevar a cabo cálculos cuantitativos, por lo que es necesario un análisis cualitativo de la respuesta de un sistema ante una perturbación.
El principio de Le Chatelier es una herramienta cualitativa que indica la dirección del desplazamiento del equilibrio. Establece que «un cambio o perturbación en cualquiera de las variables que determinan el estado de equilibrio de un sistema químico, produce un desplazamiento del equilibrio en el sentido de contrarrestar o minimizar el efecto causado por la perturbación».
Cambios en las concentraciones de las especies reaccionantes
![]()
El cociente de reacción es:
![]()
Si se añade hidrógeno, Q Kc.
Cambios en la presión y el volumen
Para una reacción química cualquiera, un aumento de la presión (o disminución del volumen) provoca un desplazamiento del equilibrio en el sentido en el que se produce un menor número de moles de gas.
Una reducción de la presión (o un aumento del volumen) desplaza el equilibrio en el sentido en el que se produce un mayor número de moles de gas.
Los cambios de presión no afectan al equilibrio cuando Dn = 0, ya que, en este caso, el número de moles gaseosos a ambos lados de la ecuación es idéntico.
En las reacciones químicas en las que sólo participan sólidos y líquidos, los cambios de presión casi no afectan al estado de equilibrio, puesto que sólidos y líquidos son prácticamente incompresibles.
Tags: resumen clases
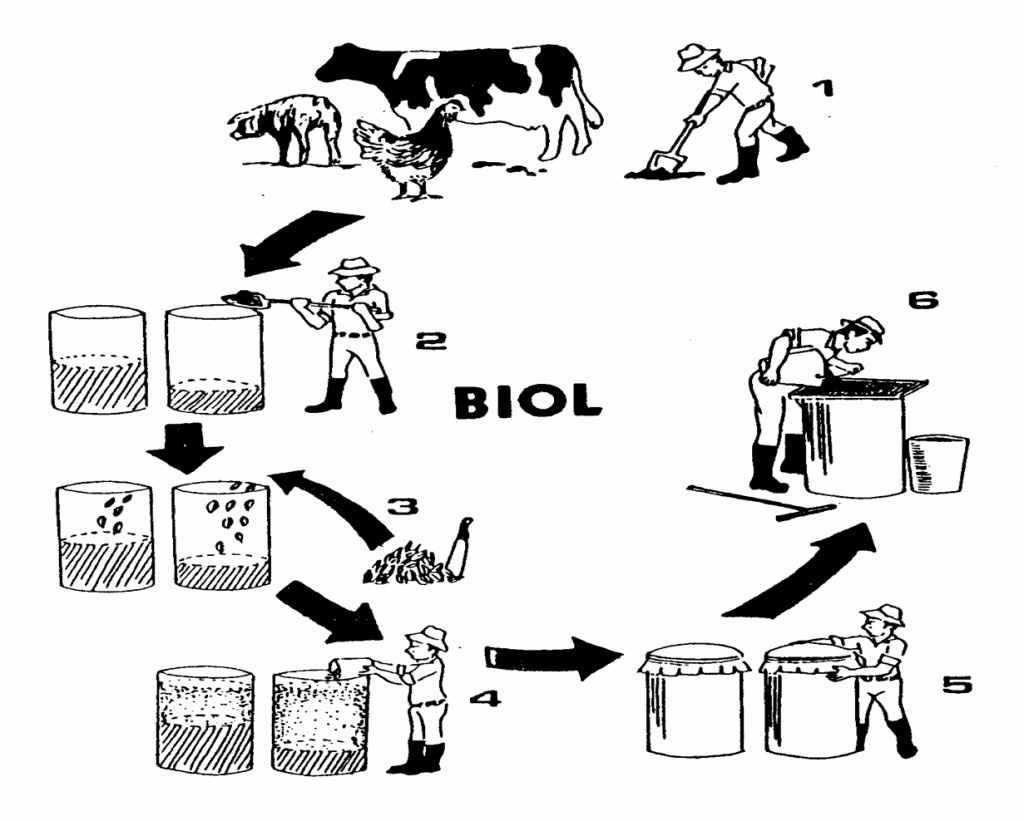
BIOL
Se obtiene del proceso de descomposición anaeróbica de los desechos orgánicos.. En un biodigestor
El Biol es el liquido que se descarga de un digestor y sirve como abono foliar, fuente orgánica de fitoreguladores que estimulan el desarrollo de las plantas.
PRODUCCIÓN DEL BIOL
MATERIALES
Estiércol (de ganado, porcino o gallinaza)
Tanques digestores
Machete, pala, baldes
Alfalfa o leguminosa picada
Plástico u otro cobertor
Mallas
Pasos para la preparación
Recolectar el estiércol
Poner en un tanque la mitad del estiércol y en el orto la cuarta parte
Poner la leguminosa picada
Llenar los tanques con agua y sellar los tanques herméticamente y dejar fermentar por 90 días
Filtrar el biol
USO DEL BIOL
AL FOLLAJE
AL SUELO
A LA SEMILLA
A LAS PLANTULAS
EN BULBOS
“VIVENCIAS DEL CURSO DE VERANO EN CIENCIA POLAR,
Jul 31
2009
 “VIVENCIAS DEL CURSO DE VERANO EN CIENCIA POLAR,
“VIVENCIAS DEL CURSO DE VERANO EN CIENCIA POLAR,
UNIVERSITY CENTRE IN SVALBARD (NORUEGA), 2009.
41ma Mesa de Diálogo
Lugar: Sala de Sesiones ICQA (2do Piso Alto)
Día: Miércoles 29 de Julio de 2009
Hora: 11:30; Finalización: 12:30
Repetición:
Día: Viernes 31 de Julio de 2009
Hora: 09:30; Finalización: 10:30
Lugar: CC. BB. Aula BA11
TÓPICO:
Vivencias del Curso de Verano en Ciencia Polar, University Centre in Svalbard (Noruega)
Instructor: Bióloga Nadia Ordoñez Román
Facilitador: Ph. D. V. A. Riofrío T. (-ICQA-
GRACIAS NADIA…..HEMOS APRENDIDO MUCHAS COSAS…
Ecuador tiene el buque Orion que a realizado trabajos de investigación en la estación cientifica Pedro Vicente Maldonado.

41 MESA DE DIALOGO
“VIVENCIAS DEL CURSO DE VERANO EN CIENCIA POLAR,
UNIVERSITY CENTRE IN SVALBARD (NORUEGA), 2009.
ANDREA PILAR ROMERO
Nadia estudio Biologia en la ESPOL donde se encuentra ahora en su proceso de graduación, ella es una joven, guapa, inteligente y emprendedora, estuvimos escuchando sus experiencias en su curso de verano en el artico donde aprendio bastante:
De lo que mas me llamo la atención:
• Hay 2000 personas en la ciudad y hay 3000 osos polares que aunque son hermosos son muy peligrosos, hay algunas técnicas de seguridad entre ellas el uso de armas que emiten luces de bengala para ahuyentarlos y en ultimo de los casos se usa el rifle, cosa que no es tan recomendable ya que los osos polares están protegidos.
• Hay también renos que migran según la estación del año donde en verano hay luz solar todas las 24 horas y en invierno oscuridad total por el mismo tiempo, las poblaciones nativas van siguiendo a los renos alimentándose de ellos y fabricando su ropa y demás implementos de ellos, se dice que los cambio climaticos afectara primero a este tipo de población ya que los polos serán los primeros en sentir los cambios.
• Es importante compartir los conocimientos con otras personas, esos nos dara oportunidades de crecer intelectualmente y nos ayudara a desarrollar algunas otras actitudes de liderazgo.
• Las oportunidades de aprender se presentan siempre, pero debemos estar preparados.
• El segundo idioma es muy importante es este tiempo donde todo es mas competitivo debemos adquirir capacidades que nos mantengan al dia y actualizados con los requerimientos y los avances del mundo moderno y educativo.

CATALISIS
Jul 27
2009
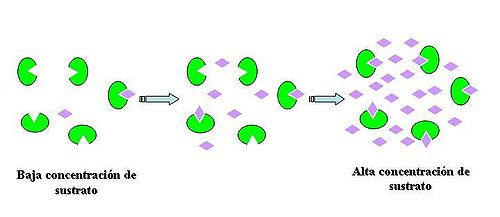
La catálisis es el proceso a través del cual se acelera una reacción química a través de una sustancia conocida como catalizador, que ni se crea ni se consume en la reacción global.
CATALISIS
El desarrollo de la ciencia y la tecnología de las últimas décadas ha estado indudablemente ligado a la industria del petróleo, debido a la gran cantidad de materiales y productos que se obtienen de ésta. Sin embargo, este desarrollo hubiera sido prácticamente imposible si no se hubiera tenido en cuenta la catálisis. Se considera que en la actualidad, el 90% de los procesos de transformación química del petróleo son catalíticos.
Básicamente, la catálisis es un fenómeno donde intervienen unas sustancias, llamadas catalizadores, en reacciones químicas donde, sin su presencia, dichas reacciones ocurrían de una forma muy lenta o nunca ocurrían, por razones de tipo termodinámico. Estos catalizadores intervienen dentro del ciclo de reacción, pero se regeneran en el último paso de la reacción, y por tal motivo no se consumen, permaneciendo idealmente inalterados durante el proceso neto.
Detrás de esta primera aproximación tan sencilla, hay todo un cúmulo de conocimiento y trabajo desarrollado por muchas personas, que involucra la aplicación de muchas disciplinas: cinética química, fisicoquímica, física de superficies, ingeniería química, química orgánica e inorgánica, física del estado sólido, entre otras. Asimismo, la industria, las universidades y otras entidades públicas y privadas han invertido una cantidad enorme de tiempo y recursos en investigación y desarrollo en este campo del conocimiento.
A nivel biológico y bioquímico, sería imposible concebir la vida sin las reacciones catalíticas. Una de las definiciones de metabolismo es el proceso de cambios químicos por los que las células producen energía y asimilan sustancias. No soy bioquímico ni biólogo, pero me atrevería a decir que la gran mayoría de estos cambios serían imposibles si no existiera un tipo especial de catalizadores proteínicos bioquímicos muy específicos, llamados enzimas, los cuales permiten sintetizar y producir sustancias indispensables para la supervivencia de cualquier organismo vivo en la Tierra.
La catálisis no se aplica únicamente a nivel biológico. Su aplicación práctica más extensa se ha hecho en el campo de la industria petroquímica, a través de procesos tales como el cracking (la ruptura de hidrocarburos pesados en hidrocarburos más pequeñas para su uso como gasolina, principalmente), el reformado de combustibles, los procesos de hidrotratamiento
(hidrodesulfuración, hidrodenitrogenación, hidrodemetalización) para reducir las impurezas del petróleo, entre otros.
Sin embargo, la catálisis también ha hecho que otros campos y aplicaciones del conocimiento hayan tenido grandes progresos, tales como la industria farmacéutica y biotecnología (producción de etanol y otros tipos de fermentaciones enzimáticas, antibióticos), la industria de alimentos (hidrogenación de ácidos grasos), la ciencia de materiales (fibras sintéticas, plásticos, y otros, aunque gran parte de estos hacen parte de la industria petroquímica), control de la contaminación e ingeniería ambiental (reducción de óxidos de nitrógeno, convertidores catalíticos en automóviles, reducción de compuestos azufrados), la industria de fertilizantes (síntesis de amoniaco, producción de hidrógeno), etc.
La ciencia de la catálisis es una respuesta práctica moderna a la antigua piedra filosofal que los alquimistas de la Edad Media buscaban afanosamente para transformar metales baratos en oro, la sustancia más apreciada para ese entonces. Ahora, no se busca la transformación en oro, sino la transformación de materias primas baratas en materias primas con alto valor agregado, con mucha utilidad en el mundo de hoy.
VELOCIDAD DE CATALIZADOR
AVANCE SEMANAL PROYECTO LABORATORIO DE QUIMICA
Esta semana terminamos el proceso de encurtidos con vinagre, estamos revisando el proceso en almíbar y tendremos el día 1 de agosto la actividad de difusión, esta semana enviaremos la invitación y las indicaciones del lugar.
EL PH: El pH es una medida de la acidez o basicidad de una solución. El pH es la concentración de iones hidronio [H3O+] presentes en determinada sustancia. La sigla significa «potencial de hidrógeno» (pondus Hydrogenii o potentia Hydrogenii; del latín pondus, n. = peso; potentia, f. = potencia; hydrogenium, n. = hidrógeno). Este término fue acuñado por el químico danés Sørensen, quien lo definió como el logaritmo negativo de base 10 de la actividad de los iones hidrógeno. Esto es:
Desde entonces, el término «pH» se ha utilizado universalmente por lo práctico que resulta para evitar el manejo de cifras largas y complejas. En disoluciones diluidas, en lugar de utilizar la actividad del ion hidrógeno, se le puede aproximar empleando la concentración molar del ion hidrógeno.Por ejemplo, una concentración de [H3O+] = 1 × 10–7 M (0,0000001) es simplemente un pH de 7 ya que: pH = –log[10–7] = 7
El pH típicamente va de 0 a 14 en disolución acuosa, siendo ácidas las disoluciones con pH menores a 7 (el valor del exponente de la concentración es mayor, por que hay más protones en la disolución) , y básicas las que tienen pH mayores a 7. El pH = 7 indica la neutralidad de la disolución (donde el disolvente es agua).


SE PONE A HERVIR AGUA

ESCALDADO: SE HIERVE POR 3 MINUTOS(CRONOMETRADO)

SE ESCURREN CUIDANDO QUE SALGA TODA EL AGUA

SE VIERTEN LAS VERDURAS EN AGUA CON HIELO

SE ESCURREN Y SE ENVASAN EN FRASCOS PREVIAMENTE ESTERILIZADOS

SE PONE EL VINAGRE PREVIAMENTE CALENTADO POR 20 MIN Y SE TAPA PONIENDO EL FRASCO BOCAABAJO PARA QUE NO QUEDEN VACIOS

gRACIAS A NUESTRA PROFESORA LA DR. MANZANO QUE SIEMPRE ESTA PARA AYUDARNOS

Suele tener el objetivo de ablandar un alimento o hacer más fácil su posterior pelado). con el fin de limpiarlos para el consumo humano y que queden libres de germenes. El escaldado es una etapa muy empleada en las industrias alimentarias. En este caso el principal objetivo consiste en la inactivación de enzimas y se suele realizar como etapa previa a procesos de congelación. Por ejemplo, si se realizase la congelación de verduras, p.ej. guisantes, sin escaldar la enzima polifenoloxidasa produciría un pardeamiento debido su actuación consistente en la transformación de polifenoles en melaninas
Julio 22-09
QUIMICA GENERAL
ANDREA PILAR ROMERO
40 MESA DE DIÁLOGO «PASOS FUNDAMENTALES PARA UNA FORMACIÓN DE EXCELENCIA»
ESPOSITOR: VICENTE ORDOÑEZ
El día viernes tuvimos la oportunidad de participar en la 40 mesa de diálogo «Pasos Fundamentales para una formación de excelencia», organizada por el Dr. Vicente Riofrio, quien ha invitado a Vicente Ordoñez para hablarnos de algunos aspectos importantes que le fueron útiles para el desarrollo de su vida profesional. a continuación lo más importante:
Vicente Ordoñez graduado de la Espol recientemente compartió algunos pasos importantes para llegar a tener éxito:
1. APRENDER DE LOS DEMAS: Podemos aprender de los demás(familia, amigos, compañeros de trabajo y personas que no conocemos)
2. ES IMPORTANTE TENER UNA RED POSITIVA DE CONTACTOS : Nuestros amigos mas cercanos son nuestros contactos mas fuertes.
3. TENER AUTOCONFIANZA:
• Liberarse de los prejuicios de uno mismo
• No confundir la autoconfianza con la falta de humildad
• La creatividad es la decisión de actuar no la capacidad
• Debemos estar orgullosos de nosotros mismos
4. CONSUMIDORES VS PRODUCTORES
• Lectores
• Observadores
• Oyentes
• Escritores
• Comunicadores
• Participantes
• Trabajadores
5. OPORTUNIDADES DIFÍCILES DE IDELTIFICAR-RECHAZO
• Ser perseverante
• Habrá muchas oportunidades de encontrar rechazo
• Explorar otras áreas
6. APRENDER DE LOS ERRORES
Conocerse a si mismo
7. DESEAR
• Siempre desear algo mas
• La crisis es potenciador de éxito/el éxito ante la necesidad
8. OTRAS NECESIDADES
Crear comunidades de aprendizaje
9. PREPARASE-METAS Y RESULTADOS
• El trabajo en grupo es algo importante que todavía no se enseña en las universidades.
• La inteligencia no es el único factor que ayuda a tener éxito
• Buscar herramientas de otras disciplinas
10. ORGANIZARSE
Ser ordenado nos permitirá establecer prioridades
Fueron pocos los asistentes pero los invitamos a participar el próximo miércoles a las 11.30 a.m de la próxima mesa de dialogo.
Publicado en el blogespol/andreromero


CINETICA QUIMICA
Jul 22
2009
CLASE DE CINETICA QUIMICA ANTES DE LAS OBRAS DE TEATRO…
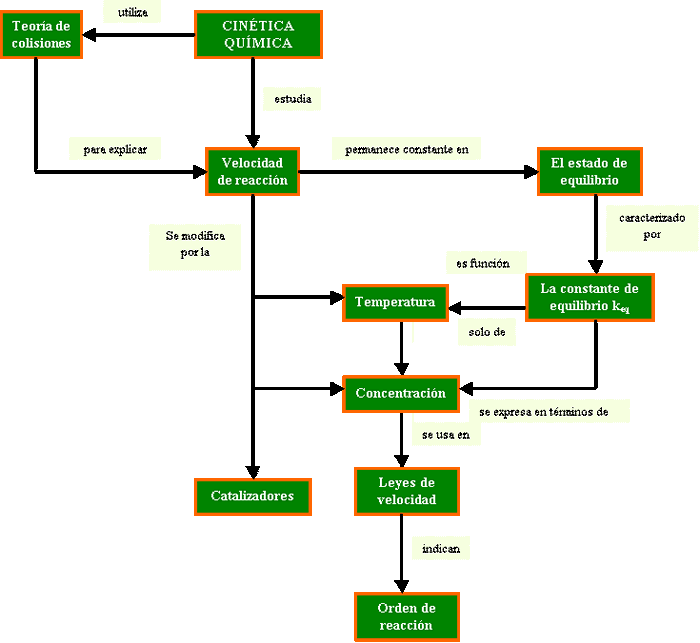
La cinética química estudia la velocidad de las reacciones químicas y los mecanismos mediante los que se efectúan. En 1864, Cato M. Guldberg y Peter Waage establecieron que la velocidad de reacción depende de la concentración de las especies reaccionantes y luego se conoció como la ley de acción de masas, que indica que la velocidad de reacción química es directamente proporcional a las masas activas de las especies reaccionantes. La masa activa depende del número de especies reaccionantes por unidad de volumen y se usa como sinónimo de concentración molar.
La velocidad de reacción química es la rapidez con que disminuye la concentración de un reactivo en la unidad de tiempo. La ley de acción de masas expresa que la velocidad de una reacción química es a cada instante proporcional a las concentraciones de los reactivos, estando cada una de las concentraciones elevada a una potencia igual al número de moléculas de cada especie que participa en la reacción química. El orden de reacción química es igual a la suma de los exponentes a los cuales están elevadas las concentraciones en la ecuación de velocidad de reacción.
De acuerdo con la ley de acción de masas, la velocidad de reacción de cualquier reacción química monomolecular del tipo:
A —> Productos, la velocidad de reacción en cualquier instante t es proporcional a la concentración de A y se representa mediante la ecuación: -dC/dt = k1CA . Donde –dC/dt representa la rapidez con que se transforman los reactivos en productos o la disminución de la concentración de los reactivos en el tiempo t, CA representa la concentración del reactivo A en el tiempo t y k1 se denomina velocidad de reacción específica o constante de velocidad de reacción de primer orden.
Si a es la concentración inicial y x la cantidad de A que se ha transformado por la reacción química en el tiempo t, entonces CA = (a – x) y sustituyendo en la ecuación de velocidad de reacción se tiene:
-d(a – x)/dt = dx/dt = k1(a – x), de donde reacomodando para integrar se tiene: òdx/(a – x) = k1òdt y tomando límites se obtiene: [-ln(a – x)]xo = [k1t]xo se obtiene ln(a/a – x) = k1t
Se define tiempo de vida media, t1/2, o periodo de vida media de una reacción química como el tiempo necesario para que se consuma o se transforme la mitad de la concentración inicial del reactivo, es decir, a – x = a/2. Sustituyendo en la ecuación anterior y despejando el tiempo de vida media se tiene:
t1/2 = 1/k1ln(a/a/2) = ln2/k1 = 0.693/k1
En la ecuación cinética anterior, se puede observar que en una reacción química de primer orden el tiempo de vida media es independiente de la concentración inicial de reactivo.
Dado que la radiactividad es un fenómeno nuclear, el proceso de desintegración no es alterado por un cambio en el estado o en las condiciones de la muestra. Un núclido radiactivo emite el mismo tipo de radiación a la misma velocidad con independencia del compuesto del que forme parte, de su temperatura, de la presión aplicada o de la presencia de campos electrostáticos, magnéticos o gravitacionales.
Los radionúclidos tienen diferentes estabilidades y se desintegran a distintas velocidades. Algunos se desintegran casi totalmente en fracciones de segundo, mientras que otros se desintegran en millones de años.
El decaimiento radiactivo de un núcleo inestable es un proceso que se representa mediante la ecuación de la velocidad de reacción química de primer orden -dC/dt = k1CA, pero usando una nomenclatura diferente: -dN/N = ldt donde –dN representa el número de núcleos que se desintegran en el intervalo de tiempo dt y l representa la constante de decaimiento del material radiactivo. La ecuación integrada es ln(N0/N) = lt o también ln(N0/N) = k1t, donde N0 representa el número de radionúclidos del inicio y N representa el número de desintegraciones por unidad de tiempo.
La radiactividad es un proceso aleatorio, en general, independiente de las influencias externas. Cuando el sistema está formado por un número grande de átomos el proceso de desintegración radiactiva es más predecible que cuando son átomos individuales. Se puede hacer mediante una propiedad característica de cada radioisótopo llamada vida media.
El tiempo de vida media o vida media (t1/2) de una muestra radiactiva es el tiempo que requiere para que la mitad de los núcleos de la muestra de un isótopo radiactivo se desintegre.
Como las desintegraciones radiactivas se comportan como las reacciones químicas de primer orden o reacción unimolecular como: A ——> Productos, la ecuación para determinar el tiempo de vida media de una muestra radiactiva es: t1/2 = ln2/ l = 0.693/l = t.
Para desintegración Cu64 ——> Zn64 + b- el tiempo de vida media es: t = 12.8 h.
La rapidez de desintegración de una muestra radiactiva se caracteriza por su tiempo de vida media.
El plutonio-240, producido en los reactores nucleares, tiene un tiempo de vida media de 6.58×103 años.
Se puede calcular la fracción restante del isótopo original después de un número dado de vidas medias por medio de la relación siguiente: 1/2n, donde “n” es el número de vidas medias transcurridas.
La cinética química estudia la velocidad de las reacciones químicas y los mecanismos mediante los que se efectúan. En 1864, Cato M. Guldberg y Peter Waage establecieron que la velocidad de reacción depende de la concentración de las especies reaccionantes y luego se conoció como la ley de acción de masas, que indica que la velocidad de reacción química es directamente proporcional a las masas activas de las especies reaccionantes. La masa activa depende del número de especies reaccionantes por unidad de volumen y se usa como sinónimo de concentración molar.
La velocidad de reacción química es la rapidez con que disminuye la concentración de un reactivo en la unidad de tiempo. La ley de acción de masas expresa que la velocidad de una reacción química es a cada instante proporcional a las concentraciones de los reactivos, estando cada una de las concentraciones elevada a una potencia igual al número de moléculas de cada especie que participa en la reacción química. El orden de reacción química es igual a la suma de los exponentes a los cuales están elevadas las concentraciones en la ecuación de velocidad de reacción.
De acuerdo con la ley de acción de masas, la velocidad de reacción de cualquier reacción química monomolecular del tipo:
A —> Productos, la velocidad de reacción en cualquier instante t es proporcional a la concentración de A y se representa mediante la ecuación: -dC/dt = k1CA . Donde –dC/dt representa la rapidez con que se transforman los reactivos en productos o la disminución de la concentración de los reactivos en el tiempo t, CA representa la concentración del reactivo A en el tiempo t y k1 se denomina velocidad de reacción específica o constante de velocidad de reacción de primer orden.
Si a es la concentración inicial y x la cantidad de A que se ha transformado por la reacción química en el tiempo t, entonces CA = (a – x) y sustituyendo en la ecuación de velocidad de reacción se tiene:
-d(a – x)/dt = dx/dt = k1(a – x), de donde reacomodando para integrar se tiene: òdx/(a – x) = k1òdt y tomando límites se obtiene: [-ln(a – x)]xo = [k1t]xo se obtiene ln(a/a – x) = k1t
Se define tiempo de vida media, t1/2, o periodo de vida media de una reacción química como el tiempo necesario para que se consuma o se transforme la mitad de la concentración inicial del reactivo, es decir, a – x = a/2. Sustituyendo en la ecuación anterior y despejando el tiempo de vida media se tiene:
t1/2 = 1/k1ln(a/a/2) = ln2/k1 = 0.693/k1
En la ecuación cinética anterior, se puede observar que en una reacción química de primer orden el tiempo de vida media es independiente de la concentración inicial de reactivo.
Dado que la radiactividad es un fenómeno nuclear, el proceso de desintegración no es alterado por un cambio en el estado o en las condiciones de la muestra. Un núclido radiactivo emite el mismo tipo de radiación a la misma velocidad con independencia del compuesto del que forme parte, de su temperatura, de la presión aplicada o de la presencia de campos electrostáticos, magnéticos o gravitacionales.
Los radionúclidos tienen diferentes estabilidades y se desintegran a distintas velocidades. Algunos se desintegran casi totalmente en fracciones de segundo, mientras que otros se desintegran en millones de años.
El decaimiento radiactivo de un núcleo inestable es un proceso que se representa mediante la ecuación de la velocidad de reacción química de primer orden -dC/dt = k1CA, pero usando una nomenclatura diferente: -dN/N = ldt donde –dN representa el número de núcleos que se desintegran en el intervalo de tiempo dt y l representa la constante de decaimiento del material radiactivo. La ecuación integrada es ln(N0/N) = lt o también ln(N0/N) = k1t, donde N0 representa el número de radionúclidos del inicio y N representa el número de desintegraciones por unidad de tiempo.
La radiactividad es un proceso aleatorio, en general, independiente de las influencias externas. Cuando el sistema está formado por un número grande de átomos el proceso de desintegración radiactiva es más predecible que cuando son átomos individuales. Se puede hacer mediante una propiedad característica de cada radioisótopo llamada vida media.
El tiempo de vida media o vida media (t1/2) de una muestra radiactiva es el tiempo que requiere para que la mitad de los núcleos de la muestra de un isótopo radiactivo se desintegre.
Como las desintegraciones radiactivas se comportan como las reacciones químicas de primer orden o reacción unimolecular como: A ——> Productos, la ecuación para determinar el tiempo de vida media de una muestra radiactiva es: t1/2 = ln2/ l = 0.693/l = t.
Para desintegración Cu64 ——> Zn64 + b- el tiempo de vida media es: t = 12.8 h.
La rapidez de desintegración de una muestra radiactiva se caracteriza por su tiempo de vida media.
El plutonio-240, producido en los reactores nucleares, tiene un tiempo de vida media de 6.58×103 años.
Se puede calcular la fracción restante del isótopo original después de un número dado de vidas medias por medio de la relación siguiente: 1/2n, donde “n” es el número de vidas medias transcurridas.
RESUMEN DE LA CLASE CINETICA QUIMICA
Jul 13
2009
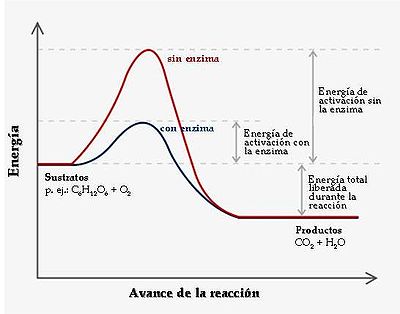
Factores que influyen en la velocidad de reacción [editar]Existen varios factores que afectan la velocidad de una reacción química: la concentración de los reactivos, la temperatura, la existencia de catalizadores y la superficie de contactos tanto de los reactivos como del catalizador. Los catalizadores negativos se llaman electrocatalizador y los positivos catalizadores normales
Temperatura [editar]Por norma general, la rapidez de reacción aumenta con la temperatura porque al aumentarla incrementa la energía cinética de las moléculas. Con mayor energía cinética, las moléculas se mueven más rápido y chocan con más frecuencia y con más energía. El comportamiento de la constante de velocidad o coeficiente cinético frente a la temperatura = lnA − (Ea / R)(1 / T2 − 1 / T1) esta ecuación linealizada es muy útil a puede ser descrito a través de la Ecuación de Arrhenius K = Aexp( − EA / RT) donde K es la constante de la velocidad, A es el factor de frecuencia, EA es la energía de activación necesaria y T es la temperatura, al linealizarla se tiene que el logaritmo neperiano de la constante de velocidad es inversamente proporcional a la temperatura, como sigue: ln(k1 / k2) la hora de calcular la energía de activación experimentalmente, ya que la pendiente de la recta obtenida al graficar la mencionada ley es: -EA/R, haciendo un simple despeje se obtiene fácilmente esta energía de activación, tomando en cuenta que el valor de la constante universal de los gases es 1.987cal/K mol. Para un buen número de reacciones químicas la velocidad se duplica aproximadamente cada diez grados centígrados.
Estado Físico de los Reactivos [editar]Si en una reacción interactúan reactivos en distintas fases, su área de contacto es menor y su velocidad también es menor. En cambio, si el área de contacto es mayor, la velocidad es mayor.
Al encontrarse los reactivos en distintas fases aparecen nuevos factores cinéticos a analizar. La parte de la reacción química, es decir hay que estudiar las velocidades de transporte, pues en la mayoría de los casos estas son mucho más lentas que la velocidad intrínseca de la reacción y son las etapas de transporte las que determinan la cinética del proceso.
No cabe duda de que un mayor área de contacto reduce la resistencia al transporte, pero también son muy importantes la difusividad del reactivo en el medio, y su solubilidad, dado que esta es el límite de la concentración del reactivo, y viene determinada por el equilibrio entre las fases.
Presencia de un catalizador [editar]Los catalizadores (La sustancia que acelera o retarda un proceso químico) aumentan la rapidez de una reacción sin transformarla, además empeoran la selectividad del proceso, aumentando la obtención de productos no deseados. La forma de acción de los mismos es modificando el mecanismo de reacción, empleando pasos elementales con mayor o menor energía de activación.
Existen catalizadores homogéneos, que se encuentran en la misma fase que los reactivos (por ejemplo, el hierro III en la descomposición del peróxido de hidrógeno) y catalizadores heterogéneos, que se encuentran en distinta fase (por ejemplo la malla de platino en las reacciones de hidrogenación).
Los catalizadores también pueden llegar a retardar reacciones, no solo acelerarlas, en este caso se suelen conocer como inhibidores.
Concentración de los reactivos [editar]La mayoría de las reacciones son más rápidas cuanto más concentrados se encuentren los reactivos. Cuanta mayor concentración, mayor frecuencia de colisión…
La obtención de una ecuación que pueda emplearse para predecir la dependencia de la velocidad de reacción con las concentraciones de reactivos es uno de los objetivos básicos de la cinética química. Esa ecuación, que es determinada de forma empírica, recibe el nombre de ecuación de velocidad. De este modo si consideramos de nuevo la reacción hipotética la velocidad de reacción «r» puede expresarse como Los términos entre corchetes son las molaridades de los reactivos y los exponentes m y n son coeficientes que, salvo en el caso de una etapa elemental no tienen por que estar relacionados con el coeficiente estequiométrico de cada uno de los reactivos. Los valores de estos exponentes se conocen como orden de reacción.
Hay casos en que la velocidad de reacción no es función de la concentración, en estos casos la cinética de la reacción está condicionada por otros factores del sistema como por ejemplo la radiación solar, o la superficie específica disponible en una reacción gas-sólido catalítica, donde el exceso de reactivo gas hace que siempre estén ocupados todos los centros activos del catalizador.
Presión [editar]En una reacción química, si existe una mayor presión en el sistema, ésta va a variar la energía cinética de las moléculas. Entonces, si existe una mayor presión, la energía cinética de las partículas va a disminuir y la reacción se va a volver más lenta. Excepto en los gases, que al aumentar su presión aumenta también el movimiento de sus partículas y, por tanto, la velocidad de reacción.
Energía de Activación [editar]En 1888, el químico sueco Svante Arrhenius sugirió que las moléculas deben poseer una cantidad mínima de energía para reaccionar. Esa energía proviene de la energía cinética de las moléculas que colisionan. La energía cinética sirve para originar las reacciones, pero si las moléculas se mueven muy lento, las moléculas solo rebotarán al chocar con otras moléculas y la reacción no sucede. Para que reaccionen las moléculas, éstas deben tener una energía cinética total que sea igual o mayor que cierto valor mínimo de energía llamado energía de activación (Ea). Una colisión con energía Ea o mayor, consigue que los átomos de las moléculas alcancen el estado de transición. Pero para que se lleve a cabo la reacción es necesario también que las moléculas estén orientadas correctamente. La constante de la velocidad de una reacción (k) depende también de la temperatura ya que la energía cinética depende de ella. La relación entre k y la temperatura está dada por la ecuación de Arrhenius:
o, también, expresada en forma de logaritmos neperianos:
Donde A es el factor de frecuencia de la materia prima con la presión..








0